题目内容
6.氯气的实验室制法: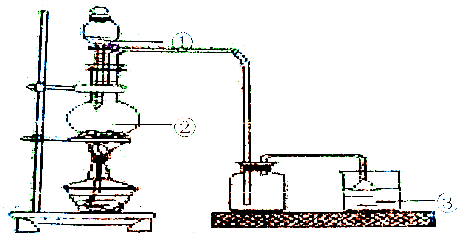
(1)实验室制备氯气的化学反应方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)试验装置图:
a.各实验仪器中所装的药品:
①浓盐酸,②MnO2,③NaOH溶液
b.倒扣漏斗的作用是:防倒吸.
分析 (1)实验室用浓盐酸和二氧化锰加热制取氯气;
(2)a.分液漏斗中盛放浓盐酸;烧瓶中盛放二氧化锰固体;氯气有毒,不能直接排空,氯气能和碱溶液反应生成盐,所以可以用碱液吸收氯气;
b.为防止产生倒吸现象,尾气处理中用倒置漏斗.
解答 解:(1)实验室用浓盐酸和二氧化锰加热制取氯气,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)a.分液漏斗中盛放浓盐酸,所以①中盛放的是浓盐酸;烧瓶中盛放二氧化锰固体,所以②中盛放的是MnO2;氯气有毒,不能直接排空,氯气能和碱溶液反应生成盐,所以可以用碱液吸收氯气,所以③中药品可以是NaOH溶液,
故答案为:浓盐酸;MnO2;NaOH溶液;
b.氯气极易和NaOH溶液反应而导致压强急剧减小,为防止产生倒吸现象,尾气处理中用倒置漏斗,
所以倒置漏斗的作用是防倒吸,故答案为:防倒吸.
点评 本题考查实验室制取氯气方法,为高频考点,明确实验原理是解本题关键,知道倒置漏斗作用,为易错点.

练习册系列答案
相关题目
14.除去乙酸乙酯中的乙酸最好的方法是( )
| A. | 用水洗 | B. | 用盐酸洗 | ||
| C. | 用氢氧化钠溶液洗 | D. | 用饱和Na2CO3溶液 |
15.某草酸亚铁样品(FeC2O4•xH2O)中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:5Fe2++5C2O42-+3MnO4-+24H+═5Fe3++10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后,继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为cmL
③重复以上实验1-2次.
④数据处理.
请回答下列问题:
(1)上述实验方案中的步骤③是重复以上实验1-2次.
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ.检验活塞是否漏水.
Ⅱ.用高锰酸钾标准溶液润洗滴定管.
Ⅲ.加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数.
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有KSCN溶液的试管中,如溶液中没有出现血红色(或红色),则说明溶液合格.
(4)某小组的一次测定数据记录如表:
根据数据计算0.1970g 样品中:n(Fe2+)═0.001110mol; n(C2O42-)═0.001010mol;FeC2O4 的质量分数为73.81%(精确到0.01%).
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后,继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为cmL
③重复以上实验1-2次.
④数据处理.
请回答下列问题:
(1)上述实验方案中的步骤③是重复以上实验1-2次.
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ.检验活塞是否漏水.
Ⅱ.用高锰酸钾标准溶液润洗滴定管.
Ⅲ.加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数.
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有KSCN溶液的试管中,如溶液中没有出现血红色(或红色),则说明溶液合格.
(4)某小组的一次测定数据记录如表:
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1970 | 0.00 | 31.30 | 42.40 |
16.下列物质含分子最多的是( )
| A. | 1.806×1024个O2 | B. | 5NA个水分子 | ||
| C. | 标准状况下89.6LCl2 | D. | 4mol CO2 |
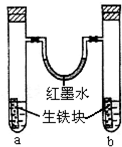 如图装置中,U型管内为红墨水,a,b试管内分别盛有是食盐水和醋酸溶液,各加入生铁快,放置右方时间,请回答下列问题:
如图装置中,U型管内为红墨水,a,b试管内分别盛有是食盐水和醋酸溶液,各加入生铁快,放置右方时间,请回答下列问题: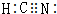 ,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形.
,其中Y原子的杂化方式是sp,ZW3-的空间构型为平面三角形. ,其中的化学键属于共价键(填“离子”或“共价”).
,其中的化学键属于共价键(填“离子”或“共价”). 铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.
铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.