题目内容
Ⅰ铁盐、亚铁盐是实验室常用的药品。
请根据题意,完成下列填空:
(1)向酸化的FeCl3溶液中逐滴加入KI溶液,溶液变成棕褐色。该反应的离子方程式为 。
(2)向酸化的FeSO4溶液中加几滴硫氰化钾溶液,没有什么明显变化,再滴加双氧水,溶液变红色。继续滴加双氧水,红色逐渐褪去,且有气泡产生。
写出上述变化中,有关反应的离子方程式:
①
②Fe3++3SCN-=Fe(SCN)3
③11H2O2+2SCN-=2SO42-+2CO2↑+N2↑+10H2O+2H+
若生成1mol N2,H2O2和SCN-的反应中转移电子的物质的量是 mol。
(3)根据以上实验,推断Fe2+、I-和SCN-的还原性由强到弱的顺序为 。
Ⅱ某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理。
(4)实验前:①先用0.1 mol·L-1H2SO4洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液通入 (写化学式)。
(5)如图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH 随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应生成的阳离子分别是 、 。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是 。
(15分)
Ⅰ.(1)2Fe3++2I-=2Fe2+ +I2 (2分);
(2)2Fe2+ +H2O2+2H+= 2Fe3+ +2H2O (2分);22(2分);
(3)I->Fe2+>SCN- (2分)
Ⅱ.(4)除去Fe粉表面的铁锈(Fe2O3)等杂质 (2分);N2 (1分)
(5)Fe2+、NH4+ (各1分,共2分);
溶液的pH增大,Fe2+形成了Fe(OH)2或与溶液中OH—结合(2分)
解析试题分析:
(1)Fe3+具有氧化性,I-具有还原性,二者发生氧化还原反应生成Fe2+和I2。
(2)酸性条件下H2O2氧化Fe2+生成Fe3+和水。反应③中H2O2作氧化剂,S和N被氧化,每生成1molN2转移22mol电子。
(3)由2Fe3++2I-=2Fe2+ +I2 可知还原性I->Fe2+;由FeSO4溶液中加几滴硫氰化钾溶液,无明显变化可知还原性SCN-<Fe2+。
(4)用硫酸除去铁表面的铁锈。为防止氧气对脱氮的影响,可通入氮气。
(5)由图像可知t1时刻前生成的阳离子是Fe2+、NH4+。Fe与NO3-生成Fe2+和NH4+,Fe2+浓度没有增大可能的原因是溶液pH增大,Fe2+形成了Fe(OH)2。
考点: 离子方程式 氧化还原反应 化学反应图像的分析

 阅读快车系列答案
阅读快车系列答案多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质(Cl2、Br2等)相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
| | 卤素 | 氰 | 硫氰 | ① |
| “单质” | X2[ | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 盐 | KX | KCN | KSCN | KOCN |
(1)在表中①②空格处应分别填写_______、_______。
(2)①(CN)2和KOH溶液反应的化学方程式为:__________________________。
②已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为( )
| A.9.6g | B.6.4 g | C.3.2 g | D.2.4 g |
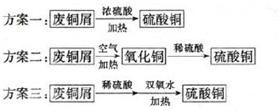
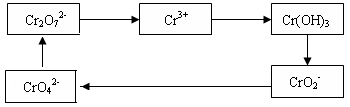
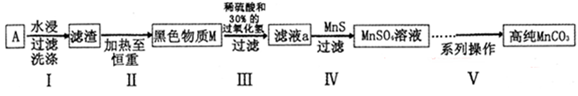
 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6