题目内容
铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强。工业上往往采取下列循环工艺防止铬的污染: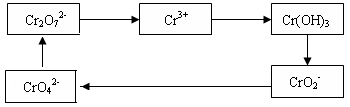
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下:
Cr2O72- + Fe3O4 + H+ → Cr3+ + Fe3+ + H2O
配平上述离子反应方程式,并标出反应中电子转移的方向和数目。
(2)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。写出从该沉淀中分离出Cr(OH)3的离子方程式 、
。
(3)回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I-
准确称取纯净的K2Cr2O7 0.1225g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为 (保留四位有效数字)。
(1) (4分,其中配平:2分,标出电子转移方向:1分,数目:1分)
(4分,其中配平:2分,标出电子转移方向:1分,数目:1分)
(2)Cr(OH)3+OH-→CrO2-+2H2O (1分)
CrO2- + 2H2O + CO2→Cr(OH)3↓+HCO3-(1分)
(3)0.1000 mol/L(2分,有效数字有错或没有单位扣1分)。
解析试题分析:(1)根据质量守恒和得失电子守恒不难写出相关化学方程式;
(2)根据反应物和产物,不难写出相关化学方程式:Cr(OH)3+OH-→CrO2-+2H2O ;CrO2- + 2H2O + CO2→Cr(OH)3↓+HCO3-;
(3)根据方程式得到:Cr2O72- -------3I2 ------6S2O32- ×6=0.025L×c(Na2S2O3),c(Na2S2O3)="0.1000" mol/L。
×6=0.025L×c(Na2S2O3),c(Na2S2O3)="0.1000" mol/L。
考点:考查化学方程式书写、化学方程式配平和相关计算。

向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。淀粉KI溶液中通入SO2气体,溶液无明显变化。则下列分析中正确的是
| A.白色沉淀是CuI2,棕色溶液含有I2 |
| B.滴加KI溶液时,转移2mol e- 时生成1mol白色沉淀 |
| C.通入SO2时,SO2与I—反应,I—作还原剂 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下层渗透,遇到难溶的ZnS或PbS,慢慢转化为铜蓝(CuS)。下列分析正确的是
| A.CuS的溶解度大于PbS的溶解度,Ksp(ZnS)<Ksp(CuS) |
| B.原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C.CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓ |
| D.整个过程涉及的反应类型有氧化还原反应和复分解反应 |