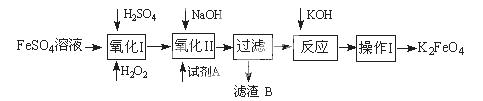
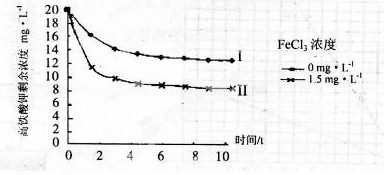
题目内容
多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质(Cl2、Br2等)相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
| | 卤素 | 氰 | 硫氰 | ① |
| “单质” | X2[ | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 盐 | KX | KCN | KSCN | KOCN |
(1)在表中①②空格处应分别填写_______、_______。
(2)①(CN)2和KOH溶液反应的化学方程式为:__________________________。
②已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
(8分)(1)氧氰 HSCN
(2)① (CN)2+2KOH=KCN+KOCN+H2O ② (CN)2+2SCN-=2CN-+ (SCN)2
解析试题分析:(1)、由氰、硫氰的组成可知,(OCN)2可视为(SCN)2中的S被O取代所得的物质,因此①或(OCN)2的名称为氧氰;由单质与酸的组成可知,②的化学式为HSCN;(2)、①Cl2与KOH的反应式为Cl2+2KOH=KOCl+KCl+H2O(或KClO+KCl+H2O),结合表中盐的组成,由相似性类比可知,(CN)2+2KOH =KOCN+KCN+H2O;阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-,由氧化还原的强弱规律可知,氧化性强弱顺序为:Cl2>Br2>(CN)2>(SCN)2>I2,由强制弱原理可知,(CN)2不能氧化Br-,只能氧化强还原性的SCN-,则反应式为(CN)2+2KSCN=2KCN+(SCN)2,离子方程式为(CN)2+2SCN-=2CN-+ (SCN)2。
考点:考查卤素、拟卤素、信息迁移能力、氧化还原反应、化学方程式、离子方程式等相关知识。

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH 、Fe3+ 、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO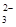 、AlO 、AlO |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧 化钠溶液的体积(V)的关系如图所示。
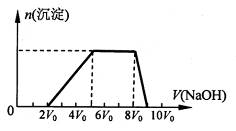
①该溶液中一定含有的阳离子是______________,其对应物质的量浓度之比为________,一定不存在的阴离子是_____________;
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示, 分析后回答下列问题:
| Cl2的体积(标准状况) | 5.6 L | 11.2 L | 22.4 L |
| n (Cl-) | 2.5 mol | 3.0 mol | 4.0 mol |
| n (Br-) | 3.0 mol | 2.8 mol | 1.8 mol |
| n (I-) | x mol | 0 | 0 |
①当通入Cl2的体积为5.6 L时,溶液中发生反应的离子方程式为_______________;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+ 、Cl-和Co2+。下列叙述不正确的是
| A.氧化产物为Cl2 |
| B.氧化剂与还原剂的物质的量之比为1∶2 |
| C.若有3mol H2O生成,则反应中有2mol电子转移 |
| D.当该反应生成2.24L Cl2时,则反应中有0.1mol电子转移 |