题目内容
【题目】下列叙述正确的是( )
A.24g镁与27g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,氧原子数相同
C.1mol/L NaOH溶液中,含Na+数目为NA
D.标准状况下,NA个四氯化碳分子所占的体积约为22.4L
【答案】B
【解析】
A、n(Mg)=![]() =1mol,n(Al)=
=1mol,n(Al)=![]() =1mol,由于Mg原子的质子数为12,Al原子的质子数为13,故1mol Mg的质子数为12NA,1mol Al的质子数为13NA,二者所含质子数不同,A错误;
=1mol,由于Mg原子的质子数为12,Al原子的质子数为13,故1mol Mg的质子数为12NA,1mol Al的质子数为13NA,二者所含质子数不同,A错误;
B、设质量都为m g,则n(O2)=![]() =
=![]() mol,n(O3)=
mol,n(O3)=![]() =
=![]() mol,二者所含氧原子个数都是
mol,二者所含氧原子个数都是![]() 个,B正确;
个,B正确;
C、题中没有告知溶液的体积,无法计算NaOH的物质的量,C错误;
D、常温下,CCl4为液态,则标况下CCl4一定是非气态,故不能使用Vm=22.4L/mol进行计算,D错误;
故选B。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
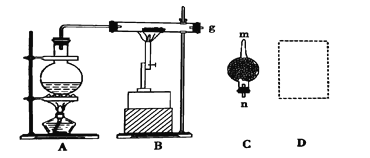
学练快车道口算心算速算天天练系列答案【题目】某小组探究清洗试管(内壁附着银镜)的反应原理,进行下列实验。
I.初步探究
(1)将稀硝酸加入附着银镜的试管中,记录现象如下:
实验Ⅰ | 实验操作 | 实验现象 |
| 银镜上出现气泡,在液面下方为无色气体,在试管口附近......;试管内壁上的银逐渐溶解。 |
①补全反应中的实验现象___。
②实验Ⅰ中银镜消失发生反应的化学方程式为____。
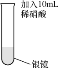
(2)为消除实验Ⅰ中氮氧化物的污染,将双氧水溶液加入附着银镜的试管中。
实验Ⅱ | 实验操作 | 实验现象 |
| 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;试管内壁上的银逐渐溶解。 |
①由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能。该实验方案是:在反应后的液体中,加入___。
②查阅资料发现:该实验中银镜溶解后最终产物为颗粒很小(直径在1~100nm之间)的Ag,其分散在液体中,肉眼无法识别。该同学通过实验证实了这种可能性。他的操作及现象是:___。
③写出该实验Ⅱ中发生反应的化学方程式:___。
II.查阅资料,继续探究
查阅文献:Ag2O+4NH3H2O=2[Ag(NH3)2]++2OH-+3H2O
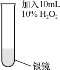
(3)探究Ag2O在H2O2分解反应中的作用,进行如下实验。
实验Ⅲ | 实验操作 | 实验现象 |
| 剧烈反应,产生大量的无色气体,同时在试管底部仍有少量黑色固体 |
根据实验Ⅲ的现象猜想:Ag2O在反应中作氧化剂。继续实验,在实验Ⅲ反应后的试管中加入足量的溶液x后,固体仍有剩余。由此验证了该猜想的正确。
①在实验中加入足量的溶液x是____。
②实验Ⅲ中发生反应的化学方程式为___。