题目内容
【题目】在容积一定的密闭容器中,可逆反应A(g)+B(g)![]() xC(g),有如图所示的关系曲线,根据如图下列判断正确的是( )
xC(g),有如图所示的关系曲线,根据如图下列判断正确的是( )
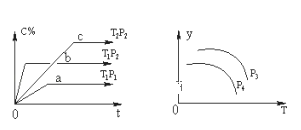
A.p3>p4,y轴表示A的物质的量分数
B.若增大A的浓度,平衡体系颜色加深,C一定是有颜色的气体
C.p3<p4,y轴表示平衡常数K
D.p3>p4,y轴表示混合气体的平均摩尔质量
【答案】D
【解析】
由左图中折线的斜率,可知p2>p1 ,T1>T2,因为压强越大,温度越高,化学反应速率越快。由左图中a、b的相对位置知,增压(因p2>p1),w(C)升高,说明增压,平衡正向移动,则正反应是气体体积减小的反应,故x=1;由b、c的相对位置知,升温(因为T1>T2),w(C)降低.说明升高温度,逆向移动,故正反应为放热反应。即该反应为:A(g)+B(g)![]() C(g)(正反应为放热反应),由反应式可知,升温和降压均可使反应向逆反应方向移动。
C(g)(正反应为放热反应),由反应式可知,升温和降压均可使反应向逆反应方向移动。
由右图可知,y随温度的升高而降低,可判断y为A的转化率或混合气体的平均摩尔质量等量,结合压强对平衡移动的影响判断p3、p4的关系。
由以上分析可知该反应为:A(g)+B(g)![]() C(g)(正反应为放热反应),
C(g)(正反应为放热反应),
A. 增大压强,平衡正向移动,A的物质的量分数应减小,故A错误;
B. 若增大A的浓度,平衡体系颜色加深,有颜色的气体也可能为A,故B错误;
C. 温度不变,则平衡常数不变,不受压强的影响,故C错误;
D. 由右图可知,y随温度的升高而降低,可判断y为A的转化率或混合气体的平均摩尔质量等量,p3>p4,说明增大压强,y值增大,则y轴表示混合气体的平均摩尔质量,故D正确;
答案选D。

【题目】某实验小组用100mL0.50mol/LNaOH溶液与60mL0.50mol/L硫酸进行中和热的测定。装置如图所示,回答下列问题:
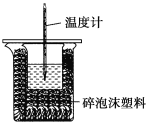
(1)若实验共需要400mLNaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体____g。
(2)图中装置缺少的仪器是____。
(3)硫酸稍过量的原因是____。
(4)请填写下表中的平均温度差:
实验 次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ____ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(5)近似认为0.50 mol/L NaOH溶液与0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容为c=4.18J/(g℃)则上述实验中和热ΔH=___(取小数点后一位)
(6)上述实验结果与57.3kJ/mol有偏差产生偏差的原因可能是____
A.量取NaOH溶液时仰视读数
B.为了使反应充分,可以向酸中分次加入碱
C.实验装置保温隔热效果差
D.用铜丝代替玻璃棒搅拌