题目内容
【题目】某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:
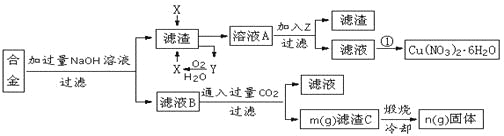
已知:
Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7
回答下列问题:
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式_______________________。试剂X的名称为______________。
(2)加入Z的作用是调节溶液的pH,pH范围应为_____;下列可作为试剂Z的是_______。
a.铜粉 b.氨水 c.氧化铜 d.硫酸铜
(3)实验操作①依次是_________、_________、过滤洗涤即可得硝酸铜晶体。
(4)测定硝酸铜晶体的结晶水含量,下列方案中肯定不可行的是______。(选填编号)
a.称量样品→加热→冷却→称量CuO
b.称量样品→加热→冷却→称量Cu(NO3)2
c.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
d.称量样品→加过量已知量的NaOH溶液→选用酚酞指示剂用标准盐酸滴定
(5)根据流程图内数据计算:滤渣C中氢氧化铝的质量分数为______________________。(用m、n的代数式表示)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高的可能性是最大的,原因有_______________________________;____________________________________。
【答案】2Al + 2OH+ 2H2O =2 AlO2+ 3 H2↑ 稀硝酸(或硝酸) 3.2≤pH<4.7 c 蒸发浓缩 降温结晶 bd ![]() 滤渣C没有洗涤,混有NaHCO3,煅烧后失重偏大 滤渣C洗涤后未烘干或烘干不达标,混有微量水,煅烧后失重偏大
滤渣C没有洗涤,混有NaHCO3,煅烧后失重偏大 滤渣C洗涤后未烘干或烘干不达标,混有微量水,煅烧后失重偏大
【解析】
(1)合金中只有铝和氢氧化钠溶液反应,则合金中加入NaOH溶液后所发生的离子反应方程式为2Al + 2OH+ 2H2O →2 AlO2+ 3 H2↑。由于最终要制备硝酸铜晶体,则试剂X的名称为稀硝酸;
(2)加入Z的作用是调节溶液的pH,根据金属阳离子沉淀时的pH值可知,要沉淀铁离子,而保留铜离子,则pH范围应为3.2≤pH<4.7;由于不能引入杂质,且能消耗氢离子,则Z可以是氧化铜;
答案选c;
(3)从溶液中得到晶体的一般操作是蒸发浓缩、降温结晶、过滤、洗涤;
(4)硝酸铜晶体受热易分解生成氧化铜、水、NO2和氧气,则
a、称量样品→加热→冷却→称量CuO,根据硝酸铜分解的方程式以及氧化铜的质量可测定Cu(NO3)2nH2O的结晶水含量,a正确;
b.因硝酸铜易分解,称量样品→加热无法恰好使结晶水合物恰好分解为硝酸铜,b错误;
c.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量,根据水的质量以及结晶水合物的质量可以求解,c正确;
d.称量样品→加过量已知量的NaOH溶液→选用酚酞指示剂用标准盐酸滴定,产生的氢氧化铜也能与盐酸反应,方案错误,d不正确;
答案选bd;
(5)煅烧后失去水的质量水mg—ng,则氢氧化铝的质量是![]() ,所以滤渣C中氢氧化铝的质量分数为
,所以滤渣C中氢氧化铝的质量分数为![]() ;
;
(6)如果氢氧化铝质量分数的测定结果偏高,这说明mn偏大,因此可能性是最大的原因有滤渣C没有洗涤,混有NaHCO3,煅烧后失重偏大;滤渣C洗涤后未烘干或烘干不达标,混有微量水,煅烧后失重偏大。