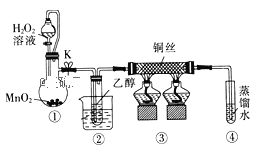
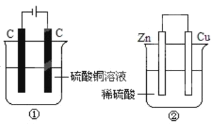
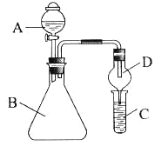
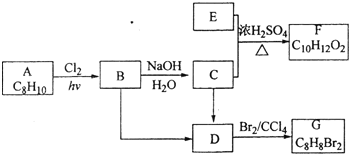
题目内容
【题目】我国科学家研发了一种新型液硫二次电池,其工作原理如图所示。下列说法错误的是
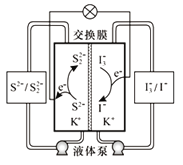
A. 放电时,电池左侧为负极,发生氧化反应
B. 充电时,电解质溶液中K+经交换膜向右侧移动
C. 放电时,电池右侧的电极反应为I3-+2e-=3I-
D. 充电时,电池的总反应为S22-+3I-![]() 2S2-+I3-
2S2-+I3-
【答案】B
【解析】
由图可知,新型液硫二次电池放电时,电池左侧为负极,S2-在负极上放电发生氧化反应生成S22-,电极反应式为2S2-—2e-= S22-,电池右侧为正极,I3-在正极上放电发生还原反应生成I-,电极反应式为I3-+2e-=3I-,充电时,原电池的负极为电解池的阴极,正极为阳极。
A项、放电时,电池左侧为负极,S2-在负极上放电发生氧化反应生成S22-,故A正确;
B项、充电时,阳离子向阴极移动,电池左侧为阴极,K+经交换膜向左侧移动,故B错误;
C项、放电时,电池右侧为正极,I3-在正极上放电发生还原反应生成I-,电极反应为I3-+2e-=3I-,故C正确;
D项、放电时电池的总反应为2S2-+I3-=S22-+3I-,则充电时电池的总反应为S22-+3I-![]() 2S2-+I3-,故D正确。
2S2-+I3-,故D正确。
故选B。

练习册系列答案
相关题目