题目内容
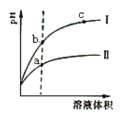
【题目】下列两个装置中,液体体积均为200mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线上都通过了0.02 mol电子,若不考虑溶液体积的变化,下列叙述中正确的是()
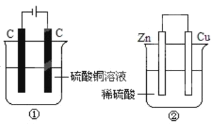
A.产生气体体积①=②
B.溶液的pH变化:①减小②增大
C.电极上析出固体质量①<②
D.电极反应式:①中阳极Cu2++2e—=Cu,②中负极Zn—2e—=Zn2+
【答案】B
【解析】
A.装置①属于电解池,阳极反应式为4OH--4e-=2H2O+O2↑,阴极反应式为Cu2++2e-=Cu,CuSO4的物质的量为200×10-3L×0.1mol·L-1=0.02mol,当电路中通过0.02mol电子,消耗Cu2+物质的量为0.01mol,只有阳极产生气体,即产生氧气的物质的量为![]() =0.005mol,体积为0.112L,装置②为原电池,正极上的反应式为2H++2e-=H2↑,产生氢气的体积为
=0.005mol,体积为0.112L,装置②为原电池,正极上的反应式为2H++2e-=H2↑,产生氢气的体积为![]() L=0.224L,故产生气体体积①<②,故A错误;
L=0.224L,故产生气体体积①<②,故A错误;
B.装置①总电极反应式为2Cu2++2H2O![]() 2Cu+O2↑+4H+,反应中产生氢离子,c(H+)增大,溶液pH减小,装置②发生Zn+H2SO4=ZnSO4+H2↑,反应中消耗氢离子,c(H+)降低,pH增大,故B正确;
2Cu+O2↑+4H+,反应中产生氢离子,c(H+)增大,溶液pH减小,装置②发生Zn+H2SO4=ZnSO4+H2↑,反应中消耗氢离子,c(H+)降低,pH增大,故B正确;
C.①的阴极反应Cu2++2e—=Cu,导线中通过0.2 mol电子时,阴极产生铜的质量m=nM=0.2mol×64g/mol=12.8g,装置②为原电池,两个电极上没有固体析出,则电极上析出固体质量①>②,故C错误
D.②中负极反应Zn-2e-=Zn2+,①中阳极4OH--4e-=2H2O+O2,故D错误;
答案选B。

【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
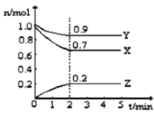
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2 、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率 v(N2) = __________,250s时,H2的转化率为____________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)反应达平衡时容器内混合气体的平均相对分子质量比起始时____(填增大、减小或不变),混合气体密度比起始时______(填增大、减小或不变)。
(5)为加快反应速率,可以采取的措施是_______
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;②沉淀I中只含有两种沉淀;③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为_________________。
(2)NaClO3在浸出液中发生的离子反应方程式为______________。
(3)加入Na2CO3调PH至5.2,目的是________;萃取剂层含锰元素,则沉淀II的主要成分为_____。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_____(回答一条原因即可)。