题目内容
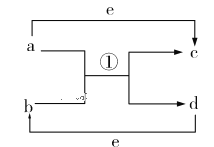
【题目】如图所示为二维平面晶体示意图,所表示的化学式为AX3的是( )
A.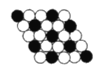 B.
B.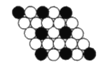 C.
C. D.
D.
【答案】B
【解析】
A. 由图可知,每个白色小球被3个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为3:6=1:2,化学式为AX2,故A错误;
B. 由图可知,每个白色小球被2个黑色小球共用,每个黑色小球被6个白色小球共用,则黑色小球和白色小球个数之比为2:6,化学式为AX3,故A正确;
C. 由图可知,每个白色小球被4个黑色小球共用,每个黑色小球被4个白色小球共用,则黑色小球和白色小球个数之比为4:4,化学式为AX,故C错误;
D. 由图可知,每个白色小球被6个黑色小球共用,每个黑色小球被3个白色小球共用,则黑色小球和白色小球个数之比为6:3=2:1,化学式为A2X,故D错误;
故选B。

【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是六种短周期元素的原子半径及主要化合价(已知铍元素的原子半径为0.089 nm)。
元素代号 | A | B | C | D | X | Y |
原子半径/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)C元素在周期表中的位置为________,其离子结构示意图为:_______。
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为___。
(3)关于C、D 两种元素说法正确的是__________(填序号)。
a.简单离子的半径D>C b.气态氢化物的稳定性D比C强 c.最高价氧化物对应的水化物的酸性C比D强
(4)在100mL18mol/L的C的最高价氧化物对应的水化物的浓溶液中加入过量的铜片,加热使其充分反应,产生气体的体积为6.72L(标况下),则该反应过程中转移的电子数为______。
(5)写出由A、D、X三种元素组成的某种可以消毒杀菌物质的电子式_____________。
(6)比较Y元素与其同族短周期元素的氢化物的熔沸点高低__ >___ (填氢化物化学式),理由___________。
【题目】利用如图装置探究铜粉与下列试剂的反应,在试管中加入一定量铜粉,加入试剂后,立即塞上橡胶塞,实验现象如下表所示,下列推断不正确的是( )
资料:Cu2++4NH3![]() [Cu(NH3)4]2+, [Cu(NH3)4]2+呈绛蓝色。
[Cu(NH3)4]2+, [Cu(NH3)4]2+呈绛蓝色。
装置 | 序号 | 试剂 | 现象 |
| ① | 10 mL浓NH3·H2O,3 mLH2O | 溶液变为绛蓝色,左侧水柱上升 |
② | 10 mL浓NH3·H2O,3 mL H2O2 | 溶液变为绛蓝色,且比①深 | |
③ | 10 mL 20% HNO3溶液,3 mL H2O | 溶液快速变蓝,产生无色气体,左侧水柱下降 | |
④ | 10 mL 20% HNO3溶液,3 mL H2O2 | 溶液变蓝比③慢,产生无色气体,左侧水柱下降 |
A.①中实验现象说明O2参与了反应
B.②中溶液颜色比①深可能是由于H2O2氧化Cu生成Cu2+
C.③中左侧水柱下降可能是反应产生NO气体导致的
D.④比③变蓝慢是由于H2O2分解造成自身消耗
【题目】在密闭容器中发生下列反应:I2(g)+H2(g)![]() 2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
编号 | 改变的条件 | 反应速率 |
(1) | 升高温度 | ______ |
(2) | 加入正催化剂 | ______ |
(3) | 再充入a mol H2 | ______ |
(4) | 将容器的容积扩大到原来的2倍 | ______ |
(5) | 保持容积不变,通入b mol Ne | ______ |