题目内容
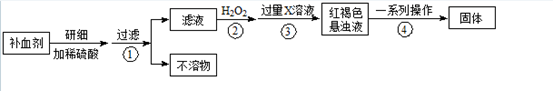
(8分)铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为:
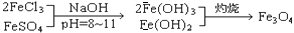
根据题意回答:
(1)现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入 g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4;
(2)如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液 mL;
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为 ;
(4)有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为: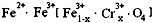 ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
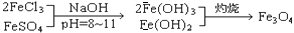
根据题意回答:
(1)现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入 g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4;
(2)如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液 mL;
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为 ;
(4)有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为:
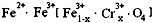 ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。(1). 16.25 g (2)700 (3)Fe4O5 或 2FeO ·Fe2O3
(4)(7.73,11.4)或(116/15,11.4)
(4)(7.73,11.4)或(116/15,11.4)
(1)2.8g铁粉可得到0.05 mol 的FeSO4,依题意还需要 0.1 mol的FeCl3,即16.25g
(2)18.0克MgO·2Fe2O3为0.05 mol,依据元素守恒可得到分别需要MgSO4和FeCl3为0.05 mol、0.2 mol,两者全部沉淀需要0.7 mol的NaOH,需1 mol/L的NaOH溶液为700 ml
(3)该产品可看出是由FeO和Fe2O3以一定量的比组成
由Fe2+~2Cl2可求出Fe2+的量也就是FeO为0.06 mol;而Fe2+经氧化后再蒸干、灼烧至恒重得9.6 g固体为Fe2O3,其物质的量为0.06 mol,也就是其中铁元素为0.12 mol,其中来自FeO的为0.06 mol,那么Fe2O3的物质的量就为0.03 mol,所以该产品的组成可表示为2FeO·Fe2O3或Fe4O5
(4)15.2 g FeSO4也就是0.1 mol的铁元素,由元素守恒可知,当x=0时,所得含铬铁氧体就是Fe3O4,其质量为116/15g;当x=1时,所得含铁氧体是Fe2CrO4,,其质量为11.4g;
(2)18.0克MgO·2Fe2O3为0.05 mol,依据元素守恒可得到分别需要MgSO4和FeCl3为0.05 mol、0.2 mol,两者全部沉淀需要0.7 mol的NaOH,需1 mol/L的NaOH溶液为700 ml
(3)该产品可看出是由FeO和Fe2O3以一定量的比组成
由Fe2+~2Cl2可求出Fe2+的量也就是FeO为0.06 mol;而Fe2+经氧化后再蒸干、灼烧至恒重得9.6 g固体为Fe2O3,其物质的量为0.06 mol,也就是其中铁元素为0.12 mol,其中来自FeO的为0.06 mol,那么Fe2O3的物质的量就为0.03 mol,所以该产品的组成可表示为2FeO·Fe2O3或Fe4O5
(4)15.2 g FeSO4也就是0.1 mol的铁元素,由元素守恒可知,当x=0时,所得含铬铁氧体就是Fe3O4,其质量为116/15g;当x=1时,所得含铁氧体是Fe2CrO4,,其质量为11.4g;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
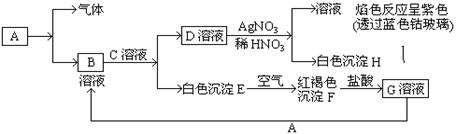
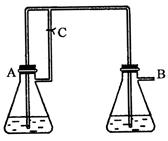
 由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用
由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用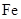 ,
, (稀),NaOH溶液可在还原性气氛中制取
(稀),NaOH溶液可在还原性气氛中制取