题目内容
(8分)已知有以下物质相互转化
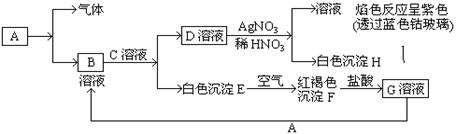
试回答:(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出F转化成G的离子方程式 ;

试回答:(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出F转化成G的离子方程式 ;
FeCl2 KCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe(OH)3+3H+==Fe3++3H2O
试题分析:根据D溶液与AgNO3溶液反应生成不溶于硝酸的白色沉淀H,因此H是AgCl。同时得到的溶液的焰色反应为紫色,说明D是KCl。根据白色沉淀E遇到空气变成红褐色沉淀F,可知E为Fe(OH)2,F为Fe(OH)3,G为FeCl3。根据B溶液和C溶液可以生成Fe(OH)2和KCl溶液,则B为FeCl3,C为KOH,A为Fe。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。

练习册系列答案
相关题目
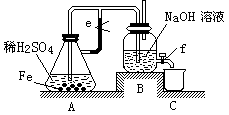
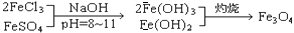
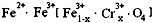 ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。