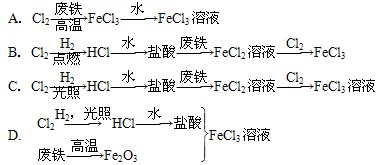
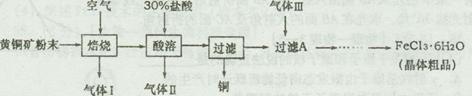
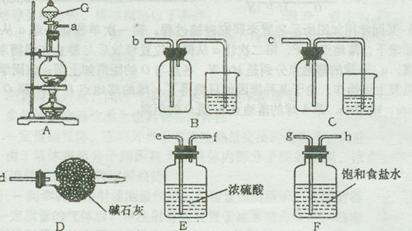
题目内容
(6分)、0.6mol·L-1Fe2(SO4)3和1.2mol·L-1CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2:1,则加入铁粉的物质的量是多少摩尔?
0.16mol
溶液中铁离子和铜离子的物质的量分别都是0.24mol。由于铜离子的氧化性弱于铁离子的,所以首先是铁离子氧化单质铁,方程式为2Fe3++Fe=3Fe2+;
如果铁离子完全反应,则生成亚铁离子是0.36mol,此时溶液中Fe2+与Cu2+物质的量之比为3︰2,这说明溶液中铁单质也和铜离子反应,方程式为Fe+Cu2+=Fe2++Cu。
设和铜离子反应的单质铁是x,则消耗铜离子是x,生成亚铁离子是x,所以有(x+0.36mol)/(0.24mol-x)=2,解得x=0.04mol,
所以加入的铁粉是0.12mol+0.04mol=0.16mol
如果铁离子完全反应,则生成亚铁离子是0.36mol,此时溶液中Fe2+与Cu2+物质的量之比为3︰2,这说明溶液中铁单质也和铜离子反应,方程式为Fe+Cu2+=Fe2++Cu。
设和铜离子反应的单质铁是x,则消耗铜离子是x,生成亚铁离子是x,所以有(x+0.36mol)/(0.24mol-x)=2,解得x=0.04mol,
所以加入的铁粉是0.12mol+0.04mol=0.16mol

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
 过滤
过滤 洗涤
洗涤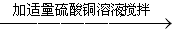 过滤
过滤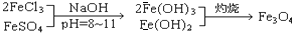
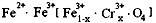 ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为 。