题目内容
pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比是
| A.11∶1 | B.9∶1 | C.1∶11 | D.1∶9 |
D
考查pH的计算。根据题意,碱是过量的,反应后溶液中c(OH-)=0.001mol/L,所以有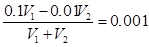 ,解得
,解得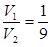 ,答案选D。
,答案选D。
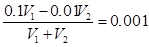 ,解得
,解得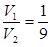 ,答案选D。
,答案选D。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
题目内容
| A.11∶1 | B.9∶1 | C.1∶11 | D.1∶9 |
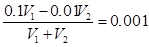 ,解得
,解得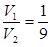 ,答案选D。
,答案选D。
 名校课堂系列答案
名校课堂系列答案