题目内容
下列化学式表示的粒子对H2O的电离平衡不产生影响的是
A.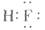 | B. | C. | D. |
C
水是一种弱电解质,存在电离平衡,方程式为H2O H++OH-。所以酸或碱能抑制水的电离,而发生水解的某些盐促进水的电离,A、D抑制水的电离,镁离子水解促进水的电离,氯离子既不能促进也不能抑制水的电离,答案选C。
H++OH-。所以酸或碱能抑制水的电离,而发生水解的某些盐促进水的电离,A、D抑制水的电离,镁离子水解促进水的电离,氯离子既不能促进也不能抑制水的电离,答案选C。
 H++OH-。所以酸或碱能抑制水的电离,而发生水解的某些盐促进水的电离,A、D抑制水的电离,镁离子水解促进水的电离,氯离子既不能促进也不能抑制水的电离,答案选C。
H++OH-。所以酸或碱能抑制水的电离,而发生水解的某些盐促进水的电离,A、D抑制水的电离,镁离子水解促进水的电离,氯离子既不能促进也不能抑制水的电离,答案选C。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 、⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是:③①④②⑥⑤
、⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是:③①④②⑥⑤