题目内容
【题目】ⅣA族元素(C、Si、Ge、Sn、Pb)及其化合物在材料等方面有重要用途。回答下列问题:
(1) Pb的价层电子排布图为:____________;
(2)GeC14的中心原子的价层电子对数为____________,分子的立体构型为___________。GeC14可水解生成一种氧化物和一种无氧酸,其化学反应方程式为:________________________________。
(3)四卤化硅![]() 的沸点和二卤化铅
的沸点和二卤化铅![]() 的熔点如下图所示。
的熔点如下图所示。

①![]() 的沸点依F、CI、Br、I次序升高的原因是____________。
的沸点依F、CI、Br、I次序升高的原因是____________。
②结合![]() 的沸点和
的沸点和![]() 的熔点的变化规律,可推断:依F、Cl、Br、I次序,
的熔点的变化规律,可推断:依F、Cl、Br、I次序,![]() 中化学键的离子性__________(填“增强”“不变”或“减弱”,下同)、共价性__________。
中化学键的离子性__________(填“增强”“不变”或“减弱”,下同)、共价性__________。

(4)碳的另一种单质![]() 可以与钾形成低温超导化合物,晶胞结构如图所示。此化合物可看成是K填充在
可以与钾形成低温超导化合物,晶胞结构如图所示。此化合物可看成是K填充在![]() 形成的所有四面体间隙和八面体间隙之中,其四面体间隙数目为_________。另有一种碱金属X(相对原子质量为M)与
形成的所有四面体间隙和八面体间隙之中,其四面体间隙数目为_________。另有一种碱金属X(相对原子质量为M)与![]() 可形成类似化合物,但X只填充
可形成类似化合物,但X只填充![]() 形成的八面体间隙的一半,此化合物的化学式为:__________,其晶胞参数为1.4nm,晶体密度为_________
形成的八面体间隙的一半,此化合物的化学式为:__________,其晶胞参数为1.4nm,晶体密度为_________![]() (用含M和阿伏伽德罗常数的值
(用含M和阿伏伽德罗常数的值![]() 的式子表示)
的式子表示)
【答案】 4 正四面体 GeC14+2H2O=GeO2+4HCl 均为组成和结构相似的共价化合物,范德华力随分子相对质量增大而增大 减弱 增强 8
4 正四面体 GeC14+2H2O=GeO2+4HCl 均为组成和结构相似的共价化合物,范德华力随分子相对质量增大而增大 减弱 增强 8 ![]()
![]()
【解析】
(1) Pb原子价层电子排布式为6s26p2,根据泡利原理与洪特规则画出价层电子排布图;
(2) GeCl4分子的中心原子为Ge,形成4个![]() 键,具有甲烷的结构特点;根据信息书写水解化学方程式;
键,具有甲烷的结构特点;根据信息书写水解化学方程式;
(3)由图象可以知道四卤化硅的沸点逐渐升高,为分子晶体,沸点与相对分子质量有关,PbX2的沸点逐渐降低,其中PbF2为离子晶体,PbBr2、PbI2为分子晶体;
(4)K位于棱和体心,C60位于顶点和面心,利用均摊法可计算化学式,结合质量、体积计算晶胞的密度大小。
(1) Pb原子价层电子排布式为6s26p2,价层电子排布图为: ,
,
因此,本题正确答案是: ;
;
(2) GeCl4分子的中心原子为Ge,价层电子对数为4,采用sp3杂化,分子的立体构型为正四面体;GeC14可水解生成GeO2和HCl,化学反应方程式为:GeC14+2H2O=GeO2+4HCl,
因此,本题正确答案是:4;正四面体;GeC14+2H2O=GeO2+4HCl;
(3)①四卤化硅的沸点逐渐升高,为分子晶体,均为组成和结构相似的共价化合物,沸点与相对分子质量有关,相对分子质量越大,沸点越高,
因此,本题正确答案是:均为组成和结构相似的共价化合物,范德华力随分子相对质量增大而增大;
②PbX2的沸点逐渐降低,其中PbF2为离子晶体,PbBr2、PbI2为分子晶体,可以知道依F、Cl、Br、I次序,PbX2中的化学键的离子性减弱、共价性增强,
因此,本题正确答案是:减弱;增强;
(4)K位于棱和体心,晶胞中的个数为12×![]() +9=12,这12个K原子其中有8个填充在
+9=12,这12个K原子其中有8个填充在![]() 形成四面体间隙之中,其余4个则填充在
形成四面体间隙之中,其余4个则填充在![]() 形成八面体间隙之中,所以其四面体间隙数目为8;另一种碱金属X只填充
形成八面体间隙之中,所以其四面体间隙数目为8;另一种碱金属X只填充![]() 形成的八面体间隙的一半,则含X个数为4×
形成的八面体间隙的一半,则含X个数为4×![]() =2,C60位于顶点和面心,个数为8×
=2,C60位于顶点和面心,个数为8×![]() +6×
+6×![]() =4,n(X):n(C60)=2:4=1:2,化学式为M(C60)2;
=4,n(X):n(C60)=2:4=1:2,化学式为M(C60)2;
则晶胞的质量为![]() g,其晶胞参数为1.4nm=1.4×10-7cm,则体积为(1.4×10-7)3cm3,所以密度为
g,其晶胞参数为1.4nm=1.4×10-7cm,则体积为(1.4×10-7)3cm3,所以密度为![]() g/cm3,
g/cm3,
因此,本题正确答案是:8;M(C60)2; 。
。

【题目】锰的化合物在工业、医疗等领域有重要应用。某兴趣小组模拟制备KMnO4及探究锰(II)盐能否被氧化为高锰(VII)酸盐。
I.KMnO4的制备:
![]()
反应原理
步骤一:3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
步骤二:3K2MnO4+2CO2 =2KMnO4+MnO2+2K2CO3
实验操作
步骤一:将一定比例的MnO2、KOH和KClO3 固体混合加热,得到墨绿色的固体,冷却后加水溶解得到碱性K2MnO4溶液放入烧杯C中。
步骤二:连接装置,检查气密性后装药品。打开分液漏斗活塞,当C中溶液完全变为紫红色时,关闭活塞停止反应,分离、提纯获取KMnO4晶体。
装置图如下:

(1)检查装置A气密性:关闭分液漏斗活塞,在B中加入蒸馏水至液面超过长导管口,用热毛巾捂住圆底烧瓶,若__________,则说明装置气密性良好。
(2)B中试剂选择的理由________。
(3)反应结束后,未能及时分离KMnO4晶体,发现C中紫红色溶液变浅。该小组同学认为是碱性K2MnO4溶液中的Cl-将生成的MnO4- 还原,导致颜色变浅,指出含有Cl-的判断依据_____________。
II.该小组继续探究Mn2+能否氧化为MnO4-,进行了下列实验:
装置图 | 试剂X | 实验现象 |
| ① 0.5mL 0.1mol/LNaOH溶液 | 生成浅棕色沉淀,一段时间后变为棕黑色 |
②0.5mL 0.1mol/LNaOH 和15%H2O2 混合液 | 立即生成棕黑色沉淀 | |
③ 0.5mL 0.1mol/LHNO3溶液 | 无明显现象 | |
④ 0.5mL 0.1 mol/LHNO3溶液和少量PbO2 | 滴加HNO3无明显现象,加入PbO2立即变为紫红色,稍后紫红色消失,生成棕黑色沉淀 |
已知:i.MnO2为棕黑色固体,难溶于水;
iiKMnO4在酸性环境下缓慢分解产生MnO2。
(4)实验①中生成棕黑色沉淀可能的原因_____。
(5)实验②中迅速生成棕黑色沉淀的离子方程式_____。
(6)对比实验③和④,实验③的作用_____。
(7)甲同学猜测实验④中紫红色消失的原因:酸性条件下KMnO4不稳定,分解产生了MnO2,乙认为不成立,理由是________;乙认为是溶液中的Mn2+将MnO4- 还原,并设计了实验方案证明此推测成立,其方案为_________。
探究结果:酸性条件下下,某些强氧化剂可以将Mn2+氧化为MnO4-。
【题目】按要求完成下列各小题
(1)25°C时,0.1 mol·L-1NH4Cl溶液的pH____7(填“<”、“=”或“>”),其原因是_________(用离子方程式表示);
(2)下列物质能导电且属于电解质的是________(填序号)。
A.铁 B.盐酸 C.氯化钠晶体 D.熔融氢氧化钠
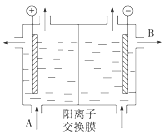
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如下图所示。
①请写出A、B两处物质的名称:A_______________,B__________________。
②请写出电解食盐水的离子方程式__________________________________________。
(4)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
若25℃时1摩尔氮气完全转化为氨气放出92.4KJ的热量,写出工业合成氨的热化学方程式____________。
(5)合成氨的原料气H2还可通过反应CO(g) + H2O(g)![]() CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为_______,该温度下反应的平衡常数K值为_________。
②保持温度仍为T ℃,只改变水蒸气和CO的初始物质的量之比,充入该容器进行反应,下列描述能够说明体系处于平衡状态的是_____________(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO) : n(H2O) : n(CO2) : n(H2) = 1: 16 : 6 : 6