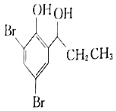
题目内容
【题目】下列说法中,不正确的是( )
A.Cl2能与大多数金属化合,生成高价金属氯化物
B.新制氯水中加入AgNO3溶液,有白色沉淀生成
C.欲除去Cl2中的大量HCl气体,可将此混合气体通过盛有饱和食盐水的洗气瓶
D.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存
【答案】D
【解析】
A.Cl2具有强的氧化性,能与大多数金属化合,对于具有多种化合价的金属元素,可以使该金属反应生成高价金属氯化物,A正确;
B.新制氯水中含有HCl,HCl电离产生Cl-,因此加入AgNO3溶液,有白色AgCl沉淀生成,B正确;
C.Cl2溶于水,与水发生反应:Cl2+H2O![]() H++Cl-+HClO,该反应是可逆反应,增大c(Cl-)的浓度,化学平衡逆向移动,降低氯气的反应,同时溶液中的水可以溶解HCl气体,故欲除去Cl2中的大量HCl气体,将此混合气体通过盛有饱和食盐水的洗气瓶,C正确;
H++Cl-+HClO,该反应是可逆反应,增大c(Cl-)的浓度,化学平衡逆向移动,降低氯气的反应,同时溶液中的水可以溶解HCl气体,故欲除去Cl2中的大量HCl气体,将此混合气体通过盛有饱和食盐水的洗气瓶,C正确;
D.漂白粉的主要成分是CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2,由于Ca(ClO)2会与空气中的CO2、H2O发生反应,导致变质,所以应密封保存,D错误;
故合理选项是D。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。

a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。