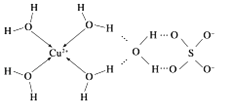
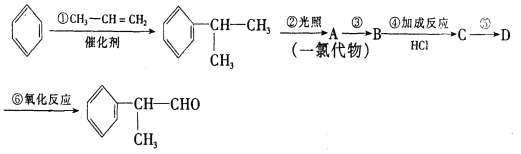
题目内容
【题目】25 ℃时,浓度均为0.1 mol/L的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是( )
A. BOH溶于水,其电离方程式是BOH===B++OH-
B. 若一定量的上述两溶液混合后pH=7,则c(A-)=c(B+)
C. 在0.1 mol/L BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+)
D. 若将0.1 mol/L BOH溶液稀释至0.001 mol/L,则溶液的pH=9
【答案】B
【解析】
试题25 ℃时,浓度均为0.1 mol·L-1的HA溶液pH分别是1,则HA是强酸;A.0.1 mol·L-1的BOH溶液,pH=11,c(H+)=10-11mol/L,则c(OH-)=10-3mol/L,因此BOH是弱碱。BOH溶于水,其电离方程式是BOH![]() B++OH-,错误;B.若一定量的上述两溶液混合后pH=7,则根据电荷守恒可得c(A-)=c(B+),正确;C.盐BA是强酸弱碱盐,在溶液中B+发生水解反应:B++H2O
B++OH-,错误;B.若一定量的上述两溶液混合后pH=7,则根据电荷守恒可得c(A-)=c(B+),正确;C.盐BA是强酸弱碱盐,在溶液中B+发生水解反应:B++H2O![]() BOH+H+,B+水解消耗,因此c(A-)>c(B+),水解使溶液中c(H+)>c(OH-),盐水解程度是微弱的,主要以盐电离产生的两种存在,因此在0.1 mol·L-1BA溶液中,离子浓度关系是c(A-)>c(B+) >c(H+)> c(OH-),错误;D.由于BOH是弱碱,因此若将0.1 mol·L-1的BOH溶液稀释至0.001 mol·L-1,则溶液的pH<9,错误。
BOH+H+,B+水解消耗,因此c(A-)>c(B+),水解使溶液中c(H+)>c(OH-),盐水解程度是微弱的,主要以盐电离产生的两种存在,因此在0.1 mol·L-1BA溶液中,离子浓度关系是c(A-)>c(B+) >c(H+)> c(OH-),错误;D.由于BOH是弱碱,因此若将0.1 mol·L-1的BOH溶液稀释至0.001 mol·L-1,则溶液的pH<9,错误。

【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
【题目】在一固定体积的密闭容器中,充入2 mol CO2和1 mol H2发生如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________。
(2)若反应在830 ℃下达到平衡,则CO2气体的转化率为________。
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度________(填“升高”、“降低”或“不能确定”)。
(4)能判断该反应是否达到化学平衡状态的依据是____________。
A 容器内压强不变 B 混合气体中c(CO)不变
C v正(H2)=v逆(H2O) D c(CO2)=c(CO)
E c(CO2 )·c(H2)=c(CO)·c(H2O)
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2=_____________。