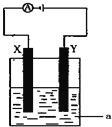
题目内容
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
【答案】C
【解析】A. 因为碳酸K1的大于氢硫酸的K1,所以碳酸的酸性强于氢硫酸,A正确;B. 多元弱酸的K1远远大于K2,所以其酸性主要由第一步电离决定,B正确;C. 常温下,加水稀释醋酸,![]() =
=![]() ,因为电离常数和水的离子积在常温下都是定值,所以其值不变,C不正确;D. 电离常数只与温度有关,向弱酸溶液中加少量NaOH溶液,电离常数不变,D正确。本题选C。
,因为电离常数和水的离子积在常温下都是定值,所以其值不变,C不正确;D. 电离常数只与温度有关,向弱酸溶液中加少量NaOH溶液,电离常数不变,D正确。本题选C。

练习册系列答案
相关题目
【题目】在一定温度下,将气体X与气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如表:下列说法正确的是( )
t∕min | 2 | 4 | 7 | 9 |
n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前4min的平均反应速率υ(Z)=0.0125molL-1min-1
B. 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大