题目内容
【题目】(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______.
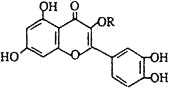
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号).
a.离子键b.共价键c.配位键d.氢键
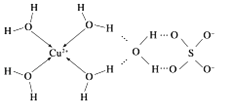
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为______ ,科学家推测胆矾结构示意图可简单表示如图:胆矾的化学式用配合物的形式表示为_____________________.
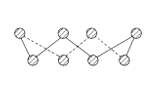
(4)第一电离能介于B、N之间的第二周期元素有______种.S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____
【答案】M 9 bcd 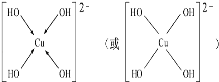 [Cu(H2O)4]SO4H2O 3 sp3杂化
[Cu(H2O)4]SO4H2O 3 sp3杂化
【解析】
(1)基态Si原子的电子排布式是1s22s22p23s23p2,第三层有3s、3p、3d 三个能级;
(2)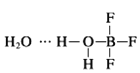 中含有水分子与水分子间的氢键、H-O键、B-F键、B-O配位键;
中含有水分子与水分子间的氢键、H-O键、B-F键、B-O配位键;
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,Cu2+与OH-通过配位键结合成[Cu(OH)4]2﹣,根据胆矾结构示意图可知Cu2﹣与H2O通过配位键结合成[Cu(H2O)4]2+。
(4)同周期元素从左到右第一电离能增大,ⅡA族的Be原子2s轨道全满,能量低,第一电离能大于相邻原子,ⅤA族的N原子2p轨道半满,能量低,第一电离能大于相邻原子;由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4。
(1)基态Si原子的电子排布式是1s22s22p23s23p2,电子占据的最高能层为第三层,符号为M,第三层有1个3s轨道、3个3p轨道、5个3d轨道,具有的原子轨道数为9;
(2)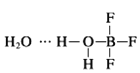 中含有水分子与水分子间的氢键、H-O键、B-F键、B-O配位键,故选bcd;
中含有水分子与水分子间的氢键、H-O键、B-F键、B-O配位键,故选bcd;
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,Cu2+与OH-通过配位键结合成[Cu(OH)4]2﹣,结构示意图为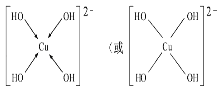 ,根据胆矾结构示意图可知Cu2+与H2O通过配位键结合成[Cu(H2O)4]2+,胆矾的化学式用配合物的形式表示为[Cu(H2O)4]SO4H2O。
,根据胆矾结构示意图可知Cu2+与H2O通过配位键结合成[Cu(H2O)4]2+,胆矾的化学式用配合物的形式表示为[Cu(H2O)4]SO4H2O。
(4)同周期元素从左到右第一电离能增大,ⅡA族的Be原子2s轨道全满,能量低,第一电离能大于相邻原子,ⅤA族的N原子2p轨道半满,能量低,第一电离能大于相邻原子,第一电离能介于B、N之间的第二周期元素有Be、C、O,共3种;由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4,S原子杂化方式是sp3杂化。

 阅读快车系列答案
阅读快车系列答案