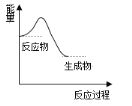
题目内容
【题目】在其他条件不变时,改变某一条件对aA(g)+bB(g)![]() cC(g)化学平衡的影响,得到如图所示图像(α表示平衡转化率),回答下列问题:
cC(g)化学平衡的影响,得到如图所示图像(α表示平衡转化率),回答下列问题:
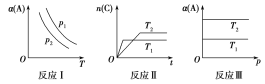
(1)在反应Ⅰ中,若p1>p2,则此正反应为___(填“吸热”或“放热”)反应,也是一个气体分子数____(填“减小”或“增大”)的反应,由此判断,此反应自发进行必须满足的条件是___。
(2)在反应Ⅱ中,T1______T2(填“>”“<”或“=”),该正反应为______(填“吸热”或“放热”)反应。
(3)在反应Ⅲ中,若T1>T2,则该正反应能否自发进行?_________。
【答案】放热 减小 低温 < 放热 能自发进行
【解析】
(1)反应Ⅰ中恒压下温度升高,α(A)减小,即升高温度平衡向左移动,△H<0;恒定温度时压强越大,α(A)越大,说明此a+b>c,即为熵减反应,△S<0;放热、熵减反应只能在低温下自发进行;
(2)“先拐先平数值大”T2温度下反应先达到平衡状态,说明T2>T1,温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应;
(3)恒温下压强变化对α(A)没有影响,说明a+b=c,△S≈0,若T1>T2,恒压下温度越高α(A)越大,说明升高温度平衡向右移动,正反应为吸热反应,△H>0,则△H-T△S>0,反应不能自发进行。
(1)反应Ⅰ中恒压下温度升高,α(A)减小,即升高温度平衡向左移动,则正反应为放热反应,△H<0;由p1>p2知恒定温度时压强越大,α(A)越大,即增大压强平衡向右移动,说明此反应为气体分子数减少的反应(a+b>c),即为熵减反应,△S<0,放热、熵减反应只能在低温下自发进行。
故答案为:放热;减小;低温。
(2)反应Ⅱ中T2温度下反应先达到平衡状态,说明T2>T1;温度越高,平衡时C的物质的量越小,即升高温度平衡向左移动,则正反应为放热反应,△H<0。
故答案为:<;放热;
(3)反应Ⅲ中在恒温下压强变化对α(A)没有影响,说明压强变化不能影响平衡,此反应为气体分子数不变的反应(a+b=c),反应过程中熵变很小,△S≈0,若T1>T2,恒压下温度越高A的体积分数越大,说明升高温度平衡向左移动,正反应为放热反应,△H<0,则△H-T△S<0,反应能自发进行。
故答案为:能自发进行。

 名校课堂系列答案
名校课堂系列答案【题目】向盛有H2O2溶液的试管中滴入少量浓盐酸,经检验生成的混合气体中只含有O2、Cl2、HCl和水蒸气。将气体通入X溶液(如图),依据观察到的现象,能判断气体中含有Cl2的是
选项 | X溶液 | 现象 |
|
A | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 | |
B | 滴有KSCN的FeSO4溶液 | 溶液变为血红色 | |
C | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
D | 紫色石蕊溶液 | 溶液先变红后褪色 |
A. A B. B C. C D. D