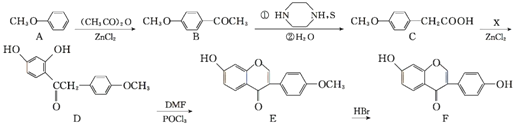
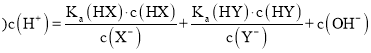题目内容
【题目】聚乙烯醇(![]() )为常见的滴眼液的主要成分,其生产过程中会产生大量副产物乙酸甲酯。用副产物乙酸甲酯催化醇解反应可制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)
)为常见的滴眼液的主要成分,其生产过程中会产生大量副产物乙酸甲酯。用副产物乙酸甲酯催化醇解反应可制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l) ΔH。已知:υ正= k正χ(CH3COOCH3)χ(C6H13OH),υ逆= k逆χ(CH3COOC6H13)χ(CH3OH),其中υ正、υ逆 为正、逆反应速率,k正、k逆为速率常数,χ为各组分的物质的量分数。
CH3COOC6H13(l)+CH3OH(l) ΔH。已知:υ正= k正χ(CH3COOCH3)χ(C6H13OH),υ逆= k逆χ(CH3COOC6H13)χ(CH3OH),其中υ正、υ逆 为正、逆反应速率,k正、k逆为速率常数,χ为各组分的物质的量分数。
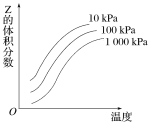
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示:
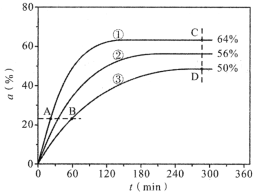
348K指的是曲线_______(填“①”“②”或“③”),判断的理由是_________;该醇解反应的ΔH_________0(填“>”或“<”)。
(2)338K时,以物质的量分数表示的化学平衡常数Kx=________;A、B、C、D四点中,υ正最大的是_______,υ逆最大的是_______。
(3)343K时,将己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1做为初始投料。则达到平衡后,初始投料比_______时,乙酸甲酯转化率最大。
(4)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是______。
a. 参与了醇解反应,但并不改变反应历程
b. 使k正和k逆增大相同倍数
c. 降低了醇解反应的活化能
d. 提高乙酸甲酯的平衡转化率
【答案】① 因为①反应达平衡的时间短,说明反应速度快,温度高 > 1 A C 2:1 bc
【解析】
(1)通过图像可以发现,随着反应进行乙酸甲酯转化率(α)先上升后不变,当转化率不变时说明反应达到了平衡状态,但三条曲线达到平衡的时间不一样,最快的是①,说明①速率最快,温度最高,且同一时间①的转化率是最高的,说明该反应温度升高向正向进行的程度在增大,该反应为吸热反应,故348K指的是曲线①,理由是①反应达平衡的时间短,说明反应速度快,温度高;ΔH>0;
(2) 338K时转化率曲线为③,平衡时乙酸甲酯转化率为50%,己醇和乙酸甲酯按物质的量之比1:1投料,根据反应CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l),达到平衡时各物质的物质的量相等,物质的量分数相等,Kx=χ(CH3COOC6H13)χ(CH3OH)/[χ(CH3COOCH3)χ(C6H13OH)]=1;
CH3COOC6H13(l)+CH3OH(l),达到平衡时各物质的物质的量相等,物质的量分数相等,Kx=χ(CH3COOC6H13)χ(CH3OH)/[χ(CH3COOCH3)χ(C6H13OH)]=1;
A、B、C、D四点中,A、C点的温度高于B、D点,A、B点反应物浓度相等,但大于C、D点,υ正最大的是A,C点转化率最大,得到的生成物浓度最大,υ逆最大的是C;
(3)要提高某一反应物的转化率,可以通过增加其他反应物的浓度来实现,以己醇和乙酸甲酯物质的量之比1:1作为参照,1:2时乙酸甲酯的转化率会降低,2:1时乙酸甲酯的转化率会升高,故2:1时乙酸甲酯转化率最大;
(4)a.催化剂参与了醇解反应,改变反应历程,a错误;
b.催化剂使正逆反应速率同等程度的增加,,即使k正和k逆增大相同倍数,b正确;
c.催化剂能降低反应的活化能,c正确;
d. 催化剂不会引起平衡的移动,无法提高转化率,d错误;
故正确的为bc。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案