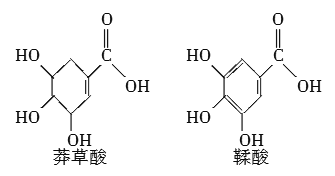
题目内容
【题目】下列离子方程式正确的是( )
A. 醋酸和碳酸钙反应:2H++CaCO3=Ca2++CO2↑+H2O
B. 铁与三氯化铁溶液反应:Fe+Fe3+=2Fe2+
C. 氢氧化钠溶液与少量二氧化硫气体:SO2+2OH-=SO32-+=H2O
D. 氯化铝溶液与足量氨水:Al3++=4NH3·H2O=AlO2-+=4NH4++2H2O
【答案】C
【解析】A、醋酸为弱电解质,在离子方程式中不可拆,故A错误;B、电荷不守恒,故B错误;C、二氧化硫少量时,与碱反应生成SO32-,故C正确;D、氢氧化铝不溶于氨水,在氯化铝中加过量的氨水只能生成氢氧化铝,故D错误。故选D。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】CO、H2、CH3、OH均是清洁能源。
(1)已知部分化学键键能数据如下:
化学键 | C | O=O | C=O | C-O |
E/(kJ mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g) △H1
H2O(g)+CO(g)==H2(g) + CO2(g) △H2 = -41 kJmol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) △H3 = -660kJmol-1
则△H1=_____ kJmol-1,反应CO(g)+2H2(g) ![]() CH3OH(g)的△H=_____ kJmol-1。
CH3OH(g)的△H=_____ kJmol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充人a mol CO与6 molH2合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。

①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②X=___________(用含a、b的式子表示),p1_____p2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为p1、温度为了T1时该反应的平衡常数K=______________。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
(3)甲醇燃料电池是一种具有高能量转化率的绿色电池,则用磷酸溶液作电解质时,负极的电极反应式为________________________。