题目内容
6.工业上生产电路板及处理废液的工艺流程如下: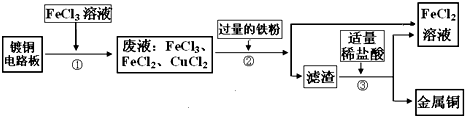
(1)由步骤①可判断FeCl3与铜反应生成的两种产物是FeCl2和CuCl2.
(2)步骤③加入稀盐酸,充分搅拌,当观察到不再有气泡产生现象时,说明滤渣只剩铜.
(3)步骤②③所得FeCl2可与一种单质发生化合反应生成FeCl3,实现循环使用.根据质量守恒定律可推测该单质的化学式为Cl2.
分析 (1)通过反应①后得到的物质可以判断生成的物质;
(2)由于加入的铁粉是过量的,所以在加入盐酸时铁要和盐酸反应,可以据此答题;
(3)根据质量守恒定律来判断分析并作出解答.
解答 解:(1)向镀铜的电路板中加入氯化铁溶液后生成了氯化铜和氯化亚铁,故答案为:FeCl2;CuCl2;
(2)加入过量的铁粉过滤后的得到滤渣应该为铁粉和铜的混合物,所以加入盐酸后,铁要和盐酸反应产生氢气,而铜不反应,所以至不在产生气泡时得到的固体只有铜单质,故答案为:不再有气泡产生;
(3)根据质量守恒定律可以知道生成的物质为氯化铁,氯化亚铁和铁不能反应,所以只能是氯化亚铁和氯气的反应,故答案为:Cl2.
点评 熟练掌握金属活动性顺序及其应用,通过对实验结果、实验流程图的分析,获得对问题的判断,体现运用基础知识分析问题的能力.

练习册系列答案
相关题目
16.下列溶液中的c(Cl-)与50mL 1mol/L FeCl3溶液中的c(Cl-)相等的是( )
| A. | 1 mol/L NaCl溶液 | B. | 2 mol/L NH4Cl溶液 | ||
| C. | 1.5 mol/L MgCl2溶液 | D. | 2 mol/L AlCl3溶液 |
1. 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示,有关该物质的说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示,有关该物质的说法中正确的是( )
 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示,有关该物质的说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示,有关该物质的说法中正确的是( )| A. | 该物质遇FeCl3溶液呈紫色 | |
| B. | 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol | |
| D. | 该分子中的所有碳原子不可能共平面 |
11.在一定条件下能说明2NO2(g)?N2O4(g)达到平衡状态的是( )
①温度和体积一定,某一物质浓度不再变化时 ②温度和体积一定,容器内压强不再变化时
③条件一定,混合气体的平均相对分子质量不再变化时 ④温度和体积一定,混合气体的颜色不再变化时 ⑤温度和压强一定,混合气体的密度不再变化时 ⑥2v正(NO2)=v逆(N2O4)
⑦单位时间内生成2x mol NO2的同时消耗x mol N2O4.
①温度和体积一定,某一物质浓度不再变化时 ②温度和体积一定,容器内压强不再变化时
③条件一定,混合气体的平均相对分子质量不再变化时 ④温度和体积一定,混合气体的颜色不再变化时 ⑤温度和压强一定,混合气体的密度不再变化时 ⑥2v正(NO2)=v逆(N2O4)
⑦单位时间内生成2x mol NO2的同时消耗x mol N2O4.
| A. | ①②③④⑤ | B. | ②③④ | C. | ①②③⑥ | D. | ③④⑤⑦ |
18.我国首创的海洋电池以铝板、铂网作电极,海水为电解质溶液,空气中的氧气与铝反应反应产生电流.电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列判断不正确的是( )
| A. | 电池工作时,电子由铝板沿导线流向铂网 | |
| B. | 铂电极做成网状,可增大与氧气的接触面积 | |
| C. | 正极反应为:O2+H2O+2e-═2OH- | |
| D. | 该电池通常只需要更换铝板就可继续使用 |
16.寒冷的冬天,经常使用暖宝宝,暖宝宝中装的是铁粉、活性炭、无机盐等物质,打开包装以后,可以连续12个小时释放热量.以下分析错误的是( )
| A. | 该过程是将化学能转化为热能 | |
| B. | 其发热原理与钢铁的电化学腐蚀相同 | |
| C. | 活性炭作正极,电极反应为:2H2O+O2+4e-═4OH- | |
| D. | 铁作负极,电极反应为:Fe-3e-═Fe3+ |
 发光二极管(LED)的材质基本以砷化镓、磷化铝镓铟(InGaAIP)、氮化铟镓(GaInN)为主.已知镓、砷分别是同族的铝、磷的下一周期元素.如图是砷化镓的晶胞结构图(白球为砷,黑球为镓).请回答:
发光二极管(LED)的材质基本以砷化镓、磷化铝镓铟(InGaAIP)、氮化铟镓(GaInN)为主.已知镓、砷分别是同族的铝、磷的下一周期元素.如图是砷化镓的晶胞结构图(白球为砷,黑球为镓).请回答: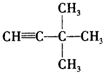 :3,3-二甲基-1-丁炔;
:3,3-二甲基-1-丁炔;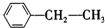 :乙苯.
:乙苯.