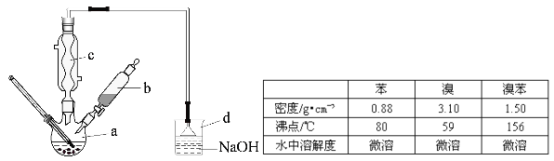
题目内容
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ. [查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
(4)硫代硫酸钠与碘反应的离子方程式为:2![]() +I2=
+I2=![]() +2I
+2I
Ⅱ. [制备产品]实验装置如图所示(省略夹持装置)
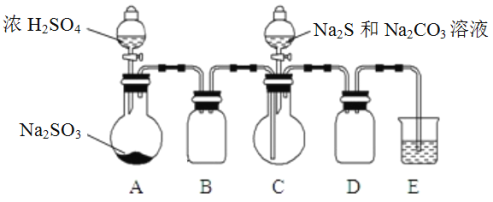
实验步骤:
(1)按如图所示组装好装置后,应先_________________________________________(填操作名称),再按图示加入试剂。仪器B和D的作用是__________________________________________;
(2)先向烧瓶C中加入Na2S和Na2CO3混合溶液,再向烧瓶A中滴加浓H2SO4。C中反应生成Na2S2O3和CO2,化学方程式为____________________________________________________________________。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经蒸发、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ. [探究与反思]
(4)用I2的标准溶液测定产品的纯度。取10.0g产品,配制成100mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除_______________________________及二氧化碳。取10.00mL溶液。以________________________________溶液为指示剂,用浓度为0.10 mol/L I2的标准溶液进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是___________________________。Na2S2O3·5H2O在产品中的质量分数是____________________________________(用百分数表示,且保留1位小数)。
【答案】检查装置的气密性 安全瓶(或防止倒吸) 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 水中溶解的氧气 淀粉 当加入最后一滴碘水时,溶液无色变蓝色,并且半分钟内不褪色 99.2%
【解析】
装置A是![]() 的发生装置,装置B和D的作用是安全瓶,防止倒吸,装置C中即反应器,发生反应制取硫代硫酸钠,而E是尾气处理装置,防止
的发生装置,装置B和D的作用是安全瓶,防止倒吸,装置C中即反应器,发生反应制取硫代硫酸钠,而E是尾气处理装置,防止![]() 污染空气,据此来解题即可。
污染空气,据此来解题即可。
(1)在组装完实验仪器后应先检查装置的气密性,再开始实验;装置B和D的作用是防倒吸;
(2)硫化钠和浓硫酸、碳酸钠反应得到硫代硫酸钠和二氧化碳:![]() ;
;
(4) 用碘来测定产品的纯度,注意这是一个氧化还原反应,因此要排除其它可能发生氧化还原反应的物质的干扰,将蒸馏水加热煮沸可以除去水中溶解的氧气;因为是用碘的标准溶液来滴定,因此可以选用淀粉溶液来作指示剂,当溶液中的硫代硫酸钠反应完后,再滴入碘液会导致碘遇淀粉变蓝;再来看实验数据,第二次溶液消耗体积与另外两次差距较大,不能使用,一、三两次平均消耗的碘液为20.00mL,根据![]() 算出碘的物质的量,则10.00mL溶液中含有的
算出碘的物质的量,则10.00mL溶液中含有的![]() 的物质的量为0.004mol,100mL中总共有0.04mol,根据
的物质的量为0.004mol,100mL中总共有0.04mol,根据![]() 算出质量,则产品的质量分数为
算出质量,则产品的质量分数为![]() 。
。

【题目】在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH<0,已知容器Ⅰ中反应在5 min时到达平衡。
COCl2(g) ΔH<0,已知容器Ⅰ中反应在5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | a | 0.55 | 0 | 0.5 |
Ⅲ | T | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A.容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B.反应Ⅲ的温度T<500℃
C.容器Ⅱ中起始时CO的物质的量为1.0 mol
D.若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率小于80%]
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持装置已略)。
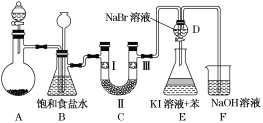
(1)制备氯气选用的试剂为漂粉精固体和浓盐酸,则相关反应的化学方程式为________________。
(2)装置B中饱和食盐水的作用是__________________________________;
同时装置B也是安全瓶,监测实验进行时装置C是否发生堵塞,请写出发生堵塞时装置B中的现象: __________________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入________(填字母)。
a | b | c | d | |
Ⅰ | 干燥的 有色布条 | 干燥的 有色布条 | 湿润的 有色布条 | 湿润的 有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的 有色布条 | 湿润的 有色布条 | 干燥的 有色布条 | 干燥的 有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D装置中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为______色,说明氯的非金属性强于溴。
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡后静置。观察到的现象是________。
【题目】自20世纪60年代以后,人们发现了120多种含铁硫簇![]() 如
如![]() 、
、![]() 、
、![]() 等
等![]() 的酶和蛋白质。它是存在于生物体的最古老的生命物质之一。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验:
的酶和蛋白质。它是存在于生物体的最古老的生命物质之一。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验:
实验一:测定硫的质量:
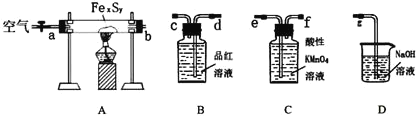
(1)连接装置,请填写接口顺序:b接____________________
(2)检查装置的气密性,在A中放入0.4g铁硫簇的样品![]() 含有不溶于水和盐酸的杂质
含有不溶于水和盐酸的杂质![]() ,在B中加入品红溶液,在C中加入30mL 0.1mol/L的酸性
,在B中加入品红溶液,在C中加入30mL 0.1mol/L的酸性![]() 溶液.
溶液.
(3)通入空气并加热,发现固体逐渐转变为红棕色.
(4)待固体完全转化后,取C中的![]() 溶液
溶液![]() ,用0.1mol/L的碘化钾
,用0.1mol/L的碘化钾![]() 溶液进行滴定。记录数据如下:
溶液进行滴定。记录数据如下:
滴定次数 | 待测溶液体积 | 消耗碘化钾溶液体积 | |
滴定前刻度 | 滴定后刻度 | ||
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
实验二:测定铁的质量:
取实验Ⅰ中A的硬质玻璃管中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经灼烧得0.32g固体.试回答下列问题:
(1)检查“实验一”中装置A的气密性的方法是_________
(2)滴定终点的判断方法是_________
(3)装置B中品红溶液的作用是_______![]() 有同学提出,撤去B装置,对实验没有影响,你的看法是______
有同学提出,撤去B装置,对实验没有影响,你的看法是______![]() 选填“合理”或“不合理”
选填“合理”或“不合理”![]() ,理由是_________
,理由是_________
(4)用KI溶液滴定![]() 溶液时发生反应的离子方程式为_________
溶液时发生反应的离子方程式为_________
(5)请计算这种铁硫簇结构的化学式_________
(6)下列操作,可能引起![]() 偏大的是_________
偏大的是_________
![]() 滴定剩余
滴定剩余![]() 溶液时,KI溶液滴到锥形瓶外边一滴
溶液时,KI溶液滴到锥形瓶外边一滴
![]() 配制KI溶液时,定容时俯视刻度线
配制KI溶液时,定容时俯视刻度线
![]() 用碘化钾溶液滴定剩余
用碘化钾溶液滴定剩余![]() 溶液时,滴定前有气泡,滴定后无气泡
溶液时,滴定前有气泡,滴定后无气泡
![]() 实验二中,对滤渣灼烧不充分
实验二中,对滤渣灼烧不充分