题目内容
I.(1)向Ba(OH)2溶液中加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式:________________________________。
(2)下列三种情况下,离子方程式与(1)相同的是_________________。
A.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至显中性
B.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至过量
Ⅱ.实验室可以用氯酸钾和浓盐酸反应制取氯气,反应式如下:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(1)用双线桥法表示上述反应中电子转移的方向和数目。
(2)反应中发生氧化反应的物质是____________(填化学式),被还原的元素是____________________(填元素名称)。
(3)氧化剂与还原剂的物质的量之比为____________________。
(4)若反应中被氧化的盐酸为1mol,则生成的氯气体积为_______________(标准状况下)。
(1)写出反应的离子方程式:________________________________。
(2)下列三种情况下,离子方程式与(1)相同的是_________________。
A.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至显中性
B.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(0H)2溶液至过量
Ⅱ.实验室可以用氯酸钾和浓盐酸反应制取氯气,反应式如下:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(1)用双线桥法表示上述反应中电子转移的方向和数目。
(2)反应中发生氧化反应的物质是____________(填化学式),被还原的元素是____________________(填元素名称)。
(3)氧化剂与还原剂的物质的量之比为____________________。
(4)若反应中被氧化的盐酸为1mol,则生成的氯气体积为_______________(标准状况下)。
Ⅰ、(1) 离子反应中易溶于水的强电解质可以拆开写成离子的形式: Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O ;(2) A
Ⅱ、(1)
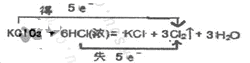
(2) HCl;氯
(3) 1︰5
(4) 13.44L
试题分析:Ⅰ、(1) Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O ;(2)B中向NaHSO4溶液中逐滴加入Ba(0H)2溶液至SO42-恰好完全沉淀时,氢氧根离子有剩余,错误;C中向NaHSO4溶液中逐滴加入Ba(0H)2溶液至过量时,也是氢氧根离子有剩余,错误;选A。
Ⅱ、(1)略
(2)氧化还原反应中,还原剂,化合价升高,被氧化,发生氧化反应,因此反应中发生氧化反应的物质是HCl;氧化剂,化合价降低,被还原,发生还原反应,因此是氯酸钾中的氯元素被还原。
(3)虽然参加反应的HCl(浓)6mol是,但是参加氧化还原的HCl(浓)只是5mol,因此氧化剂与还原剂的物质的量之比为1︰5。
(4)依(3)的分析可知,被氧化的盐酸为1mol时,生成的气体为0.6mol 转化成标况下的体积就是:13.44L

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目

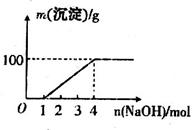
 ;⑦
;⑦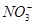 中的几种离子,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量如图所示。则该溶液中一定含有的离子是
中的几种离子,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量如图所示。则该溶液中一定含有的离子是