题目内容
对一瓶无色、澄清的稀溶液作初步分析后发现,其中可能含有SO42-、Na+、CO32-、H+、NO3-、HCO3-、Cl-等离子中的若干种。进一步的分析结果如下:
(1)用pH试纸测定溶液的pH,试纸呈红色(酸性色)
(2)取2mL溶液滴加少量BaCl2溶液,有白色沉淀生成,再滴加少量稀HNO3,沉淀不消失
(3)对(2)中所得的混合物,充分静置后,取上层清液滴加少量AgNO3溶液,又有白色沉淀生成,再滴加少量稀HNO3,沉淀不消失
则:(1)溶液中一定存在的离子是 ,一定不存在的离子是 。
(2)能否判断原溶液中是否含有Cl- (“是” 或“否” ),其原因为 ;若要确定溶液中是否含有Cl-,其正确的操作是 。
(1)用pH试纸测定溶液的pH,试纸呈红色(酸性色)
(2)取2mL溶液滴加少量BaCl2溶液,有白色沉淀生成,再滴加少量稀HNO3,沉淀不消失
(3)对(2)中所得的混合物,充分静置后,取上层清液滴加少量AgNO3溶液,又有白色沉淀生成,再滴加少量稀HNO3,沉淀不消失
则:(1)溶液中一定存在的离子是 ,一定不存在的离子是 。
(2)能否判断原溶液中是否含有Cl- (“是” 或“否” ),其原因为 ;若要确定溶液中是否含有Cl-,其正确的操作是 。
(1)H+、SO42-;CO32-、HCO3-;
(2)否;因第(2)步实验中带入了Cl-;将第(2)步中的少量BaCl2改为足量的Ba(NO3)2溶液即可。
(2)否;因第(2)步实验中带入了Cl-;将第(2)步中的少量BaCl2改为足量的Ba(NO3)2溶液即可。
试题分析:(1)用pH试纸测定溶液的pH,试纸呈红色说明含有(酸性色)H+,与H+不能共存的CO32-、HCO3-一定不存在;(2)取2mL溶液滴加少量BaCl2溶液,有白色沉淀生成,再滴加少量稀HNO3,沉淀不消失,该沉淀可能为氯化银,也可能为硫酸钡,所以不能判断是否有Cl-存在;若要确定溶液中是否含有Cl-,其正确的操作是将第(2)步中的少量BaCl2改为足量的Ba(NO3)2溶液即可。

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
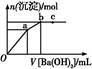
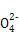 +Ba2+
+Ba2+ BaSO4↓
BaSO4↓