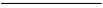题目内容
高铁酸钾(K2FeO4)具有很强的氧化性,在生产、生活中有广泛应用。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是_____。
[已知:FeO42-+3e-+4H2O Fe(OH)3+5OH-]
Fe(OH)3+5OH-]
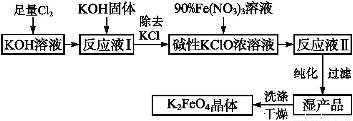
(2)制备K2FeO4可以采用湿式氧化法,流程如下图:

①完成氧化工序的离子方程式:

②除杂工序目的是除去Na2FeO4溶液中的杂质,除去的杂质主要有_____(写化学式)。
③转化工序控制在某温度下进行,则该温度下溶解度:Na2FeO4_____K2FeO4? (填“>”、“<”或“=”)。
(3)实验室模拟工业电解法制取K2FeO4,装置如右图。
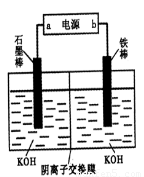
①此装置中电源的负极是____(填“a”或“b”)。
②阳极的电极反应式为______。
(4)已知K2FeO4稀溶液中存在如下平衡:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:
4Fe(OH)3+8OH-+3O2。实验测得K2FeO4溶液浓度与温度和pH的关系分别如下图所示:

①由图I可得出的结论:该反应的△H___0(填“>”、“<”或“=”)。
②图Ⅱ中pH1___pH3(填“>”、“<”或“=”)。
(1)杀菌和凝聚? (2)①ClO2-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O
②NaNO3、NaCl? ③>? (3)①a? ②Fe-6e-+8OH-=FeO42-+4H2O
(4)①>? ②<
【解析】
试题分析:(1)已知FeO42-+3e-+4H2O Fe(OH)3+5OH-,这说明K2FeO4具有强氧化性,能杀菌消毒。另外生成的铁离子水解生成氢氧化铁胶体具有吸附性,还起到净水剂的作用。
Fe(OH)3+5OH-,这说明K2FeO4具有强氧化性,能杀菌消毒。另外生成的铁离子水解生成氢氧化铁胶体具有吸附性,还起到净水剂的作用。
(2)①根据方程式可知,反应中氯元素的化合价从+1价降低到-1价,得到2个电子。铁的化合价从+3价升高到+6价,得到2个电子,因此根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是3:2。由于溶液显碱性,所以根据原子守恒可知,反应后还有水生成,则该反应的离子方程式为3ClO2-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O。
②根据原子守恒可知,反应中还有硝酸钠和氯化钠生成,所以除杂的目的是除去NaNO3、NaCl。
③根据该温度下高铁酸钠能转化为高铁酸钾,所以根据沉淀容易向更难的方向转化可知,高铁酸钠的溶解度大于高铁酸钾的溶解度。
(3)①电解法制取K2FeO4,则反应中铁应该是失去电子,所以铁是阳极,因此b是电源的正极,a是大于的负极。
②铁是阳极失去6个电子,因此阳极电极反应式为Fe-6e-+8OH-=FeO42-+4H2O。
(4)①由图I可知,温度T1首先达到平衡状态,这说明温度T1最高。但温度高K2FeO4溶液浓度越小,这说明升高温度平衡向正反应方向移动,因此正方应是吸热反应,即该反应的△H>0。
②pH越小,溶液的酸性越强,则溶液中OH-越小,有利于平衡向正反应方向移动。所以根据图2可知pH1时K2FeO4溶液浓度最小,因此pH1小于pH3。
考点:考查高碳酸盐的作用、氧化还原反应方程式配平、溶解平衡、电解原理的应用以及外界条件对平衡状态的影响等

 名校课堂系列答案
名校课堂系列答案高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
| A.有强氧化性,可消毒杀菌,还原产物水解后能吸附水中杂质 |
| B.有强还原性,可消毒杀菌,氧化产物水解后能吸附水中杂质 |
| C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌 |
| D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 |