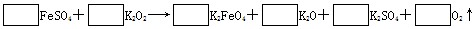题目内容
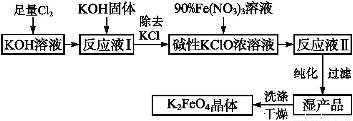
高铁酸钾(K2FeO4)是新型多功能水处理剂,碱性条件下性质稳定,其生产过程如下:

请回答下列问题
(1)氯碱工业制Cl2的化学反应方程式?????????????????????????????????? ;
(2)生成“反应液Ⅱ”的离子方程式是?????? ;(3)使用碱性KClO的原因是???? ;
(4)从“反应液II”中分离出K2FeO4后? ,副产品是KCl和?????? (填化学式),该混合物可用????????? 方法分离提纯(填字母序号);
A.过滤???????? B.分液????????? C.蒸馏?????????? D.重结晶
(5)工业生产3.96t K2FeO4,理论上消耗Cl2的物质的量为______mol。
(1)2NaCl + 2H2O 2NaOH + H2↑+ Cl2↑?
2NaOH + H2↑+ Cl2↑?
(2)3ClO- + 2Fe3+ + 10OH- = 2FeO42- + 3Cl- + 5H2O;
(3)K2FeO4在碱性条件下稳定;KClO氧化性强于K2FeO4
(4) KNO3? ; D??????
(5) 3.00 × 104
【解析】
试题分析:(1)氯碱工业就是电解饱和食盐水得到烧碱和氯气;(2)根据流程分析反应液II是利用次氯酸钾氧化铁离子得到FeO42-,结合氧化还原反应离子方程式的书写步骤可得:3ClO- + 2Fe3+ + 10OH- = 2FeO42- + 3Cl- + 5H2O;(3)题目信息:K2FeO4在碱性条件下稳定,反应需在碱性条件下进行;(4)反应中加入了硝酸铁,所以还生成KNO3,硝酸钾的溶解度随温度变化较大,可以用冷却结晶的方法分离;(5)根据氯气与碱反应和次氯酸钾与硝酸铁反应的关系式进行计算。
考点:考查分散系。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
| A.有强氧化性,可消毒杀菌,还原产物水解后能吸附水中杂质 |
| B.有强还原性,可消毒杀菌,氧化产物水解后能吸附水中杂质 |
| C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌 |
| D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 |