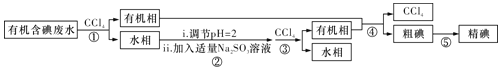
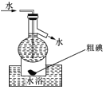
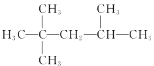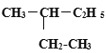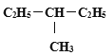题目内容
【题目】A、B、C、D四种可溶性盐,阳离子分别可能是Ba2+、Na+、Ag+、Cu2+中的某一种,阴离子分别可能是![]() 中的某一种。
中的某一种。
(1) C的溶液呈蓝色,向这四种盐溶液中分别加盐酸,B盐有沉淀产生,D盐有无色无味气体逸出。则它们的化学式应为:
A_______,B_______,C_______,D_______。
(2)写出下列反应的离子方程式:
①A+C__________________________。
②D+盐酸________________________。
【答案】BaCl2 AgNO3 CuSO4 Na2CO3 Ba2++SO42-=BaSO4↓ CO32-+2H+=H2O +CO2↑
【解析】
A、B、C、D都是可溶性盐,Ag+只能和![]() 搭配,
搭配,![]() 只能和剩余的Na+搭配,在此基础上,
只能和剩余的Na+搭配,在此基础上,![]() 和Cu2+搭配,则Ba2+和Cl-搭配,即这四种盐为AgNO3、Na2CO3、CuSO4、BaCl2。C的溶液呈蓝色,则C为CuSO4。B+HCl产生沉淀,则B为AgNO3。D+HCl产生气体,则D为Na2CO3。所以A为BaCl2。综上所述,A为BaCl2,B为AgNO3,C为CuSO4,D为Na2CO3。
和Cu2+搭配,则Ba2+和Cl-搭配,即这四种盐为AgNO3、Na2CO3、CuSO4、BaCl2。C的溶液呈蓝色,则C为CuSO4。B+HCl产生沉淀,则B为AgNO3。D+HCl产生气体,则D为Na2CO3。所以A为BaCl2。综上所述,A为BaCl2,B为AgNO3,C为CuSO4,D为Na2CO3。
(1)经分析这四种盐为AgNO3、Na2CO3、CuSO4、BaCl2,结合题中给出的实验现象,可以推出A为BaCl2,B为AgNO3,C为CuSO4,D为Na2CO3;
(2)A+C为BaCl2和CuSO4的反应,其离子方程式为:Ba2++SO42-=BaSO4↓;D+盐酸为Na2CO3和盐酸的反应,其离子方程式为:CO32-+2H+=H2O +CO2↑。

【题目】根据所学知识回答下列问题。
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的![]() 和
和![]() 单质燃烧时均放出大量热,可用作燃料.已知
单质燃烧时均放出大量热,可用作燃料.已知![]() 和
和![]() 为短周期元素,其原子的第一至第四电离能如下表所示:
为短周期元素,其原子的第一至第四电离能如下表所示:
电离能/ |
|
|
|
|
| 932 | 1821 | 15390 | 21771 |
| 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断![]() 的核外电子排布如图所示,该同学所画的电子排布图违背了_________,
的核外电子排布如图所示,该同学所画的电子排布图违背了_________, ![]() 元素位于周期表五个区域中的___ 区。
元素位于周期表五个区域中的___ 区。

②![]() 分子的中心原子
分子的中心原子![]() 采取_________杂化,
采取_________杂化, ![]() 的空间构型为___ 。
的空间构型为___ 。
(2)![]() 原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
① 与![]() 原子或离子形成配合物的分子或离子应具备的结构特征是____。
原子或离子形成配合物的分子或离子应具备的结构特征是____。
② 六氰合亚铁离子![]() 中不存在____________(填字母)。
中不存在____________(填字母)。
A.共价键 B.非极性键 C.配位键 D. ![]() 键
键
写出一种与![]() 互为等电子体的单质的分子式:________________ 。
互为等电子体的单质的分子式:________________ 。
(3)—种![]() 合金的晶胞结构如图,请据此回答下列问题:
合金的晶胞结构如图,请据此回答下列问题:
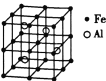
① 该合金的化学式为____________。
② 若晶体的密度为![]()
![]() ,则该晶胞棱长为____________
,则该晶胞棱长为____________![]() (设
(设![]() 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含![]() 和
和![]() 的代数式表示,不必化简)。
的代数式表示,不必化简)。
【题目】下表是元素周期表的一部分,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
4 |
(1)请画出元素⑨阴离子的结构示意图:________________________________。
(2)③⑤⑧的原子半径由小到大的顺序为________(填元素符号)。
(3)⑤和⑦的最高价氧化物对应水化物的碱性强弱为______>______(填化学式)。
(4)③⑤两种元素的原子按1∶1组成的常见化合物的电子式为__________。
(5)用电子式表示⑥和⑨形成的化合物的过程:______________________________。
【题目】下列“实验结论”与“实验操作及现象”相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向紫色石蕊溶液中加入氯水,溶液先变红,随后褪色 | 氯水中含有酸性物质和漂白性物质 |
B | 向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的气体 | 该溶液中一定含有CO |
C | 向某溶液中加入AgNO3溶液,产生白色沉淀 | 该溶液中一定含有Cl- |
D | 向蔗糖中滴加浓硫酸,蔗糖变黑 | 浓硫酸有吸水性 |
A.AB.BC.CD.D