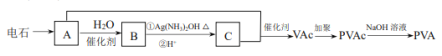
题目内容
【题目】![]() 是褐色固体,受热分解为Pb的
是褐色固体,受热分解为Pb的![]() 和
和![]() 价的混合氧化物,
价的混合氧化物,![]() 价的Pb能氧化浓盐酸生成
价的Pb能氧化浓盐酸生成![]() ,
,![]() 价的Pb还原成
价的Pb还原成![]() 价的Pb;现将
价的Pb;现将![]() 加热分解得到
加热分解得到![]() ,向剩余固体中加入足量的浓盐酸得到
,向剩余固体中加入足量的浓盐酸得到![]() ,
,![]() 和
和![]() 的物质的量之比为
的物质的量之比为![]() ,则剩余固体的组成及物质的量比是
,则剩余固体的组成及物质的量比是![]()
![]()
A.![]() 混合的
混合的![]() 、
、![]() B.
B.![]() 混合的
混合的![]() 、PbO
、PbO
C.![]() 混合的
混合的![]() 、
、![]() 、PbOD.
、PbOD.![]() 混合的
混合的![]() 、
、![]() 、PbO
、PbO
【答案】B
【解析】
![]() 受热分解得到氧气和铅的氧化物的混合物
受热分解得到氧气和铅的氧化物的混合物![]() 为
为![]() 、
、![]() 价
价![]() ,铅的氧化物的混合物再与盐酸作用时,
,铅的氧化物的混合物再与盐酸作用时,![]() 价Pb还原为
价Pb还原为![]() 价,
价,![]() 被氧化为
被氧化为![]() ,此时得到溶液为
,此时得到溶液为![]() 溶液,利用“电子转移守恒”知
溶液,利用“电子转移守恒”知![]() 在上述转化过程中共转移电子为
在上述转化过程中共转移电子为![]() ,设该过程得到
,设该过程得到![]() 的物质的量为3xmol,则
的物质的量为3xmol,则![]() 的物质的量为2xmol,利用电子转移守恒有:
的物质的量为2xmol,利用电子转移守恒有:![]() ,解得
,解得![]() ,故知
,故知![]() 在受热分解过程中产生
在受热分解过程中产生![]() 为
为![]() ,利用原子守恒可知受热后的剩余固体中
,利用原子守恒可知受热后的剩余固体中![]() ,故剩余固体中
,故剩余固体中![]() :
:![]() :
:![]() :5,
:5,
A.1:2混合的![]() 、
、![]() ,
,![]() :
:![]() :
:![]() :10,故A错误;
:10,故A错误;
B.1:1混合的![]() 、PbO,
、PbO,![]() :
:![]() :
:![]() :5,故B正确;
:5,故B正确;
C.1:4:1混合的![]() 、
、![]() 、PbO,
、PbO,![]() :
:![]() :
:![]() :19,故C错误;
:19,故C错误;
D.1:1:1混合的![]() 、
、![]() 、PbO,
、PbO,![]() :
:![]() :
:![]() :7,故D错误;
:7,故D错误;
故选B。

 阅读快车系列答案
阅读快车系列答案【题目】Cl2、漂白液(有效成分为 NaClO)在生产、生活中广泛用于杀菌、消毒。
(1)电解 NaCl 溶液生成Cl2的化学方程式是________________。
(2)Cl2溶于H2O、NaOH 溶液即获得氯水、漂白液。
①干燥的氯气不能漂白物质,但氯水却有漂白作用,说明起漂白作用的物质是_____。
②25℃,Cl2与H2O、NaOH 的反应如下:
反应Ⅰ | Cl2+H2O |
反应Ⅱ | Cl2+2OH- |
解释不直接使用氯水而使用漂白液做消毒剂的原因_____。
(3)家庭使用漂白液时,不宜直接接触铁制品,漂白液腐蚀铁的电极反应为:Fe-2e-=Fe2+;ClO-发生的电极反应式为____________。
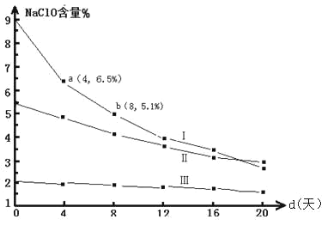
(4)研究漂白液的稳定性对其生产和保存有实际意义。30℃时,pH=11 的漂白液中NaClO 的质量百分含量随时间变化如下:
比较分解速率 v(I)、 v(II)的大小关系_____,原因是_____。
【题目】从某废液(含有Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液。现以制得纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如下:

已知:高锰酸钾(K2FeO4)位暗紫色固体,可溶于水。在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。高锰酸钾具有强氧化性。高锰酸钾(K2FeO4)与水作用产生Fe(OH)3。
(1)检验废液中含有Fe2+选用的试剂是________(填化学式);从废液中制得纯净的FeCl3溶液加入的试剂除铁粉外,还需要一种试剂是_________(填化学式),加入时发生反应的离子方程式为__________。
(2)高锰酸钾(K2FeO4)在处理水过程中的作用是_________和__________。
(3)“氧化”过程反应的离子方程式为__________。
(4)过滤时需用的玻璃仪器有玻璃棒、烧杯和________,上述工艺得到的高锰酸钾常含有杂志,可用重结晶法提纯,操作是:将粗产品用_________溶解,然后________。
(5)用回收的铜为原料可制得粗制CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂志的方法是:向溶液中加入H2O2,再调解溶液PH,过滤即可制得纯净的CuSO4溶液,进而制得纯净CuSO4·5H2O的晶体。
已知:室温时一些物质的Kaq如下表:
化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
已知溶液中的离子浓度小于1×10-6mol·L-1时就认定沉淀完全。
加双氧水的目的是__________;若溶液中CuSO4的浓度为3.0mol·L-1,通过计算说明此方法可除去粗制CuSO4·5H2O晶体中FeSO4·7H2O的理由________。