��Ŀ����
����Ŀ����֪����������Ԫ��Q��T��U��V��W��X��Y��Zԭ����������������֪��T��U��Vͬ���ڣ�W��X��Y��Zͬ���ڣ�U��Yͬ�壻Ԫ��Q��ij�ֺ���û�����ӣ�Ԫ��T���������������۵Ĵ�����Ϊ0��Q��U�γɵ���̬�������ڱ�״���µ��ܶ�Ϊ0.76g/L����ҵ��ͨ������Һ̬�������V�ĵ��ʣ��Ҹõ��ʵ�ij��ͬ���������DZ�������ر���������Ҫ���ϣ�W��X��Z������������Ӧ��ˮ��������֮�䶼�ܷ�Ӧ����W��X��Zԭ������������֮�͵���W��ԭ��������
(1)VԪ��ԭ�ӵ� L�������Ϊ______��Ԫ�� W �����ڱ��е�λ��Ϊ______��
(2)�õ���ʽ��ʾ������ QZ���γɹ���______��
(3)U���⻯���ͬ��������Ԫ�ص��⻯����۷е�����ƫ�ߣ�ԭ����______��
(4)д��X��Z ����Ԫ������������Ӧ��ˮ�������Ӧ�����ӷ���ʽ��______��
(5)T��U��V�γɵ��⻯������й��ۼ��ļ�����ǿ������˳��Ϊ______�����ѧʽ��
(6)Q��T���γ�һ�ֻ�����T2Q4����д���÷��ӵĽṹʽ________��
(7)Ԫ��Y��һ�ֺ����ữѧʽΪ H3YO3����ṹʽ�ɱ�ʾΪ��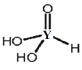 ������Ϊ______Ԫ�ᣬ��д���������������������Һ��Ӧ�Ļ�ѧ����ʽ______��(��֪��Ϣ������ԭ�ӽ�ϳɵ�һ��ԭ���š���OH�����ǻ�����������ֻ���ǻ���ſɵ���� H+��)
������Ϊ______Ԫ�ᣬ��д���������������������Һ��Ӧ�Ļ�ѧ����ʽ______��(��֪��Ϣ������ԭ�ӽ�ϳɵ�һ��ԭ���š���OH�����ǻ�����������ֻ���ǻ���ſɵ���� H+��)
���𰸡� 6 �������ڵڢ�A �� ![]() NH3 ����֮���γ���� Al(OH)3 + 3 H+ =Al3+ + 3H2O H2O> NH3>CH4
NH3 ����֮���γ���� Al(OH)3 + 3 H+ =Al3+ + 3H2O H2O> NH3>CH4 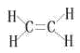 �� H3PO3+2NaOH=Na2HPO3+2H2O
�� H3PO3+2NaOH=Na2HPO3+2H2O
��������Ԫ��Q��ij�ֺ���û�����ӣ���QΪ��Ԫ������ҵ��ͨ������Һ̬�������V�ĵ���,�õ��ʵ�ij��ͬ���������DZ�������ر���������Ҫ����,��VΪ��Ԫ����TԪ����������������֮��Ϊ0��������A����ԭ������С����Ԫ��,��TΪ̼Ԫ����Q��U�γɵ���̬�������ڱ�״���µ��ܶ�Ϊ0.76g/L��0.76g/L��22.4L/mol=17g/mol��������ΪNH3����UΪNԪ�أ�U��Yͬ��,��YΪP,W��X��Y��Zͬ���ڣ�W��X��Z������������Ӧ��ˮ��������֮�䶼�ܷ�Ӧ����W��X��Zԭ������������֮�͵���W��ԭ����������WΪNa,XΪAl��ZΪCl,�ݴ˽����
(1) ��Ԫ��ԭ�ӵ� L�������Ϊ6��Ԫ���������ڱ��е�λ��Ϊ�������ڵڢ�A �塣
(2)HClΪ���ۻ�����õ���ʽ��ʾ HCl���γɹ���![]() ��
��
(3) NH3��ͬ��������Ԫ�ص��⻯����۷е�����ƫ�ߣ�ԭ����NH3 ����֮���γ������
(4) X��Z ����Ԫ������������Ӧ��ˮ����ֱ�ΪAl(OH)3��HClO4,���Ӧ�����ӷ���ʽ��Al(OH)3 + 3 H+ =Al3+ + 3H2O��
(5)�ǽ�����Խǿ���γɵ��⻯�ﹲ�ۼ�����Խ������ C��N��O�γɵ��⻯������й��ۼ��ļ�����ǿ������˳��ΪH2O> NH3>CH4 ��
(6)C2H4Ϊ��ϩ����ϩ���ӵĽṹʽΪ��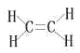 ��
��
(7) �ӽṹʽ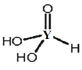 ֪���÷����к��������ǻ��⣬�ʸ���Ϊ2Ԫ�ᣬ�������������������Һ��Ӧ�Ļ�ѧ����ʽΪ��H3PO3+2NaOH=Na2HPO3+2H2O��
֪���÷����к��������ǻ��⣬�ʸ���Ϊ2Ԫ�ᣬ�������������������Һ��Ӧ�Ļ�ѧ����ʽΪ��H3PO3+2NaOH=Na2HPO3+2H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ҵ��һ���ں����ܱ������в������з�Ӧ�ϳɼ״���CO��g��+2H2��g��CH3OH��g��
��1���жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ���ͬ���� �� ��
A.����CH3OH������������CO���������
B.���������ܶȲ���
C.�����������ƽ��������������
D.CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
E.�����ѹǿ���ٸı�
��2�������������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c��CO��=0.2mol/L����CO��ת����Ϊ �� ��ʱ���¶�Ϊ ��
��3��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ�� ��
a������ b��������� c������CO��Ũ�� d�������¼���H2ʹѹǿ���
e�������¼����������ʹѹǿ��� f��������״�
��4����250��ʱ�����ij�ܱ������и����ʵ����ʵ���Ũ�ȼ�����
CO | H2 | CH3OH |
0.5molL��1 | 2molL��1 | 6molL��1 |
��ʱ��Ӧ�������淴Ӧ���ʵĹ�ϵ�ǣ�v������v���棩��������������T������
����Ŀ����������п(ZnO)��������1-100 nm֮�䣬��һ������21���͵����߹��ܾ�ϸ����Ʒ�����ֳ�������������ʡ�ij�о����Դ�����п��������CuO��FeO��MnO��Fe2O3�ȣ�Ϊԭ�ϣ�����ʪ��ѧ��(NPP-��)�Ʊ�������������п����������������ͼ��
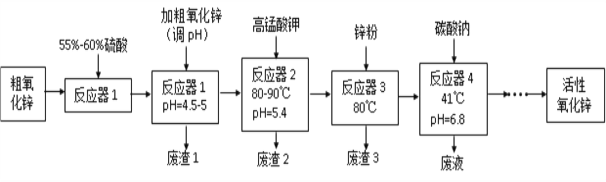
��֪��
��pH=5.4ʱ��KMnO4�Ļ�ԭ����ΪMnO2��
������ʵ�������¸����������������pH������±���ʾ��
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
��ʼ������pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
������ȫ��pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
����������Ϣ���ش��������⣺
��1�����չ����и�������õ��ķ��뷽����_______________________________��
��2��������1������Ҫ�ɷ���______________________________________________��
��3������Ӧ��2��������������ԭ��Ӧ�����ӷ���ʽΪ_______________________________________________________________
��4�� ����Ӧ��3���м���п�۵�������________________________________��
��5������Ӧ��4���õ��ķ�Һ�У����е���Ҫ���ӳ���Na+�⣬����______________��

