题目内容
【题目】某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
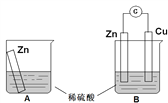
(1)A烧杯中反应的离子方程式为_________。
(2)B中Zn板是_________极,发生的电极反应是_________,Cu板上的现象是_________,发生的电极反应是_________。
(3)从能量转化的角度来看,A、B中反应物的总能量_________(填“大于”、“小于”或“等于”)生成物总能量,A中是将化学能转变为_________,B中主要是将化学能转变为_________。
(4)该小组同学反思原电池的原理,其中观点正确的是_________(填字母序号)。
A.原电池反应的过程中一定有电子转移
B.原电池装置需要2个电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
【答案】 Zn + 2H+ === Zn2+ + H2↑ 负 Zn - 2e- === Zn2+ 有大量无色气泡产生 2H+ + 2e- === H2↑ 大于 热能 电能 ABD
【解析】(1)A烧杯中锌与稀硫酸反应的离子方程式为Zn + 2H+ === Zn2+ + H2↑,故答案为:Zn + 2H+ === Zn2+ + H2↑;
(2)B中锌比铜活泼,Zn板是负极,发生的电极反应是Zn - 2e- === Zn2+,Cu板上氢离子放电生成氢气,电极反应为2H+ + 2e- === H2↑,现象为有大量无色气泡产生,故答案为:负;Zn - 2e- === Zn2+;有大量无色气泡产生;2H+ + 2e- === H2↑;
(3)从能量转化的角度来看,锌与稀硫酸的反应属于放热反应,反应物的总能量大于生成物总能量,A中是将化学能转变为热能,B中主要是将化学能转变为电能,故答案为:大于;热能;电能;
(4)A.原电池反应是一个氧化还原反应,一定有电子转移,故A正确;B.根据原电池的构成条件,原电池装置需要2个电极,故B正确;C.根据题意,锌被逐渐溶解,参加了反应,故C错误;D.根据原电池原理,氧化反应和还原反应可以拆开在两极发生,从而产生电流,故D正确;故选ABD。

 小学能力测试卷系列答案
小学能力测试卷系列答案