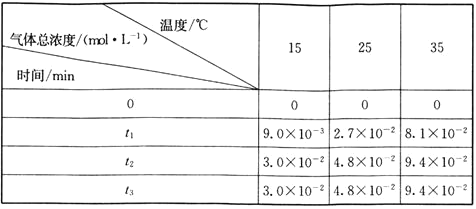
题目内容
【题目】无水三氯化铁是有机合成的催化剂,为棕黄色固体,易潮解产生白雾,300℃左右时升华。实验室可用氯气与铁反应制备无水三氯化铁,下图是甲组学生设计的制备装置。

回答下列问题:
(1)仪器a的名称是________;装置B的作用是_________,C中盛装试剂是______。
(2)装置D中发生反应的化学方程式为___________________。
(3)装置D与E之间不用玻璃导气管连接,原因是_________;点燃装置D处酒精灯的时机是_______。
(4)装置F的作用是_____________。
(5)与甲组设计对比,乙组同学去掉了装置C。实验时无论怎样改变铁粉的用量,装置D中都有少量的黑色固体残留。乙组同学猜测该黑色固体可能是__________,其依据是(用化学方程式表示)________,验证该猜测的实验方法是________。
【答案】分液漏斗 除去氯气中的HCl 浓硫酸 2Fe+3Cl2![]() 2FeCl3 防止FeCl3冷凝成固体堵塞玻璃导管 待D装置的玻璃管内充满黄绿色气体时再点燃酒精灯 吸收尾气防止污染空气,同时防止空气中的水蒸气进入装置E中 Fe3O4 3Fe+4H2O(g)
2FeCl3 防止FeCl3冷凝成固体堵塞玻璃导管 待D装置的玻璃管内充满黄绿色气体时再点燃酒精灯 吸收尾气防止污染空气,同时防止空气中的水蒸气进入装置E中 Fe3O4 3Fe+4H2O(g)![]() Fe3O4+4H2 取少量该固体,用磁铁(或铁片)靠近,若发生吸引,则推测成立(或其他合理答案)
Fe3O4+4H2 取少量该固体,用磁铁(或铁片)靠近,若发生吸引,则推测成立(或其他合理答案)
【解析】
在装置A中浓盐酸与MnO2混合加热制取Cl2,由于浓盐酸具有挥发性,制取的Cl2中含有HCl和水蒸气,装置B中饱和食盐水用于除去HCl,装置C中浓硫酸进行Cl2的干燥,在装置D中Fe与Cl2反应产生FeCl3,在装置E中收集FeCl3,为防止Cl2污染大气,同时防止FeCl3潮解,在E支管处连接一个盛有碱石灰的干燥管,用以吸收Cl2及空气中的水蒸气。
(1)根据装置图可知仪器a名称为分液漏斗;装置B中盛有饱和食盐水,作用是除去氯气中的HCl;装置C中盛有浓硫酸,作用是干燥Cl2;
(2)在装置D中Fe与Cl2在加热条件下发生反应产生FeCl3,反应方程式为:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(3)装置D与E之间不用玻璃导气管连接,是由于FeCl3蒸气冷凝变成固体时容易发生堵塞玻璃导管现象,所以就不使用导气管,直接进入收集装置锥形瓶E中;为防止Fe粉与装置中空气里含有的氧气发生反应,应该在D装置的玻璃管内充满黄绿色气体时再点燃酒精灯;
(4)装置F是盛有碱石灰的干燥管,其作用是吸收尾气中的未反应的Cl2,防止污染空气,同时防止空气中的水蒸气进入装置E中;
(5)若不使用浓硫酸干燥Cl2,在加热时Fe与空气中的H2O蒸气发生反应产生Fe3O4和H2,反应方程式为:3Fe+4H2O(g)![]() Fe3O4+4H2;Fe3O4俗称磁性氧化铁,能够被磁铁吸引,也能吸引金属铁,所以证明发生该反应的实验方法是取少量该固体,用磁铁(或铁片)靠近,若发生吸引,则推测成立。
Fe3O4+4H2;Fe3O4俗称磁性氧化铁,能够被磁铁吸引,也能吸引金属铁,所以证明发生该反应的实验方法是取少量该固体,用磁铁(或铁片)靠近,若发生吸引,则推测成立。