题目内容
【题目】A、B、C、D是原子序数依次增大的第二、三周期主族元素,A、B、C的单质(用a、b、c表示)及其化合物x、y、z有如下转化关系,D与B同主族,下列说法正确的是

A. x、y、z均是离子化合物
B. 简单氢化物的沸点:C﹥B﹥D
C. 最高价氧化物对应的水化物的酸性:A﹥D
D. 简单离子半径:D﹥C﹥B
【答案】B
【解析】A、B、C、D是原子序数依次增大的第二、三周期主族元素,A、B、C的单质(用a、b、c表示)及其化合物x、y、z有如下转化关系,D与B同主族,A为C元素,B为O元素,C为Na元素,D为S元素,x、y、z分别为CO2、Na2O2、Na2CO3。
A、X为CO2,不是离子化合物,故A错误;B、简单氢化物常温下NaH是固体、H2O为液体、H2S为气体,简单氢化物的沸点:NH3﹥H2O﹥H2S,故B正确;C、最高价氧化物对应的水化物的酸性:H2SO4>H2CO3,故C错误;D、 简单离子半径应为:S2― ﹥O2― ﹥Na+ ,故D错误;故选B。

【题目】某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
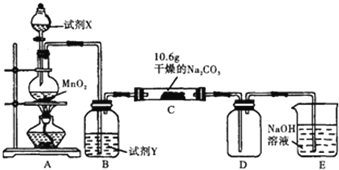
(1)装置A中发生反应的化学方程式是___。
(2)试剂Y是___;作用是___。
(3)已知:通入一定量的氯气后,测得D中有一种常温下为黄红色的气体,其为含氯的氧化物.可以确定的是C中含有氯元素的盐只有一种,且含有NaHCO3,现对C中反应后固体的成分进行猜想和探究。
提出合理假设。
假设1:存在两种成分:NaHCO3和物质W;
假设2:存在三种成分:NaHCO3、Na2CO3和物质W。
则上述假设中物质W为___(填化学式)。
设计方案,进行实验。请填写相应的实验步骤以及预期现象和结论。
限选实验试剂:稀H2SO4、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加___ | ①若无明显现象,证明固体中不含___ ②若出现___(填现象和结论) |
步骤3:向B试管中滴加___ | 若溶液中出现白色沉淀,则证明含有氯元素的盐;结合步骤2中①,则假设1成立;结合步骤2中②,则假设2成立 |
(4)若假设1成立,已知C中有0.1molCl2参加反应,推知C中反应的化学方程式为___。
【题目】请根据要求填写下列空白:
(1)NaHCO3溶液呈碱性的原因是 ______________(用方程式和必要文字表示),写出该溶液存在的物料守恒的关系式 ________________。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要产物是________________________。
(3)若想除去CuCl2 溶液中混有FeCl3杂质,则往往加入试剂 ______________。
①NaOH ②NH3·H2O ③CuO ④CuCO3
(4)在酸碱滴定中,我们用0.1000mol/L HCl来滴定未知浓度的NaOH溶液,①在滴定过程中,操作或说法错误的是_______________。
a.滴定终点为:当滴完最后一滴恰好变色,且在半分钟内不恢复原色
b.进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化
c.酸式滴定管中的盐酸装液前未经润洗,导致所测定的c(NaOH)偏低。
d.酸式滴定管在滴定前有气泡,滴定后气泡消失,导致所测定的c(NaOH)偏高
②某学生根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠 溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=________________
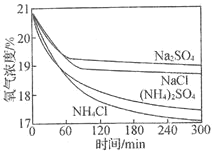
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。下列说法不正确的是
实验装置 | 实验编号 | 浸泡液 | pH | 氧气浓度随时间的变化 |
|
|
| 5 |
|
|
| 5 | ||
|
| 7 | ||
|
| 7 |
A.上述正极反应均为![]()
B.在不同溶液中,![]() 是影响吸氧腐蚀速率的主要因素
是影响吸氧腐蚀速率的主要因素
C.向实验![]() 中加入少量
中加入少量![]() 固体,吸氧腐蚀速率加快
固体,吸氧腐蚀速率加快
D.在![]() 内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液