题目内容
【题目】(1)煤的利用可以是直接燃烧,也可以是先气化再燃烧 ,下面用等量的C分别按两途径进行反应
a. C(s)+O2(g) = CO2(g) △H =E1
b. C(s) +H2O(g)=CO(g)+H2 (g) △H =E2
H2(g)+![]() O2(g)=H2O(g ) △H =E3
O2(g)=H2O(g ) △H =E3
CO(s)+![]() O2(g)=CO2(g) △H =E4
O2(g)=CO2(g) △H =E4
甲同学认为:煤的气化效率高,所以b途径产生的热量高。乙同学认为,a、b途径产生的热量在理论上应该相同,你认为_____同学说法正确,理由是______________。
(2)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)是否等于 c(M+),要看一元酸HA是强酸还是弱酸。你认为_____同学说法正确,理由是______________
【答案】乙 反应热与途径无关,只与物质的始态和终态有关(E1=E2+E3+E4) 甲 根据电荷守恒,已知c(H+)=c(OH-),所以c(A-)=c(M+)
【解析】
(1)根据盖斯定律分析解答;
(2)根据溶液呈电中性分析解答。
(1)煤气化,然后燃烧,根据盖斯定律,物质反应过程中能量变化只与物质的始态和终态有关,与反应途径无关,所以只要物质的量不变,反应物、生成物的状态不变,则反应过程的能量不变,所以a、b途径产生的热量在理论上应该相同,乙同学的认识是合理的;这可以根据热化学方程式叠加得到证实。①C(s)+O2(g) = CO2(g) △H1 =E1
②C(s)+H2O(g)=CO(g)+H2 (g) △H2=E2
③H2(g)+![]() O2(g)=H2O(g ) △H3=E3
O2(g)=H2O(g ) △H3=E3
④CO(s)+![]() O2(g)=CO2(g) △H4=E4
O2(g)=CO2(g) △H4=E4
②+③+④,整理可得C(s)+O2(g)=CO2(g),所以△H=△H2+△H3+△H4= E2+E3+E4=△H1=E1;即E1=E2+E3+E4;
(2)在任何溶液中阳离子带有的正电荷总数与阴离子带有的负电荷总数相等,所以c(M+)+c(H+)=c(OH-)+c(A-),在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性,则c(H+)=c(OH-),所以c(A-)=c(M+)。

【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
Ⅰ.探究一:备选药品:镁片、铝片、0.500 mol·L-1H2SO4、18.4 mol·L-1H2SO4。
甲同学研究的实验报告:
实验步骤 | 现象 | 结论 |
①用砂纸打磨镁片和铝片; ②分别取等体积等浓度的硫酸于两支试管中; ③将镁片和铝片同时投入到试管中。 | 金属的性质越活泼, 反应速率越快 |
(1)甲同学用砂纸打磨镁片和铝片的原因是______________________________;选择H2SO4浓度为________________。
(2) 实验报告中现象为_______________________________________________。
Ⅱ.探究二:实验室经常用Na2S2O3与H2SO4的反应探究化学反应速率的影响因素,利用图1所示装置(夹持装置略去)进行实验,观察到锥形瓶底部有淡黄色浑浊。
(3)请用化学方程式表示出实验原理_________________________________,乙同学在实验过程中对产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据并绘制出图像(如图2)。
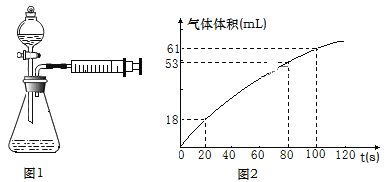
0~20s内反应速率υ1=__________mL·s-1,80~100s内反应速率υ2=__________mL·s-1。不考虑实验测量误差,分析速率差异的主要原因是_____________。