题目内容
【题目】已知:![]() H<0,将一定量的
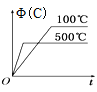
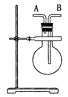
H<0,将一定量的![]() 充入注射器中密封,测定气体透光率,并压缩注射器,气体透光率随时间的变化如图
充入注射器中密封,测定气体透光率,并压缩注射器,气体透光率随时间的变化如图![]() 气体颜色越深,透光率越小
气体颜色越深,透光率越小![]() 。下列说法正确的是
。下列说法正确的是
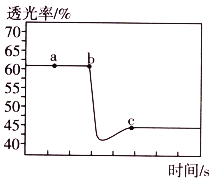
A.a点时化学反应速率为0
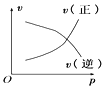
B.c点:υ正(NO2)>υ逆(NO2)
C.b点与c点相比,c(NO2)增大,c(N2O4)减小
D.若容器绝热,则平衡常数![]()
【答案】D
【解析】
A.a点气体颜色不变,说明反应达到平衡状态,正反应速率等于逆反应速率,但不为0,选项A错误;
B.c点气体颜色不变,说明反应达到平衡状态,则υ正(NO2)=υ逆(NO2),选项 B错误;
C.气体颜色越深,透光率越小,b点与c点相比,b点的透光率大,则b点与c点相比,![]() 减小,压缩注射器,反应正向移动,但由于体积减小,则b点与c点相比,
减小,压缩注射器,反应正向移动,但由于体积减小,则b点与c点相比,![]() 减小,
减小,![]() 减小,选项C错误;
减小,选项C错误;
D.b点到c点反应正向移动,且该反应![]() ,则b点的反应温度比c点的反应温度低,温度升高,反应向吸热反应的方向移动,则反应逆向移动,则平衡常数
,则b点的反应温度比c点的反应温度低,温度升高,反应向吸热反应的方向移动,则反应逆向移动,则平衡常数![]() ,选项D正确。
,选项D正确。
答案选D。

【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
Ⅰ.探究一:备选药品:镁片、铝片、0.500 mol·L-1H2SO4、18.4 mol·L-1H2SO4。
甲同学研究的实验报告:
实验步骤 | 现象 | 结论 |
①用砂纸打磨镁片和铝片; ②分别取等体积等浓度的硫酸于两支试管中; ③将镁片和铝片同时投入到试管中。 | 金属的性质越活泼, 反应速率越快 |
(1)甲同学用砂纸打磨镁片和铝片的原因是______________________________;选择H2SO4浓度为________________。
(2) 实验报告中现象为_______________________________________________。
Ⅱ.探究二:实验室经常用Na2S2O3与H2SO4的反应探究化学反应速率的影响因素,利用图1所示装置(夹持装置略去)进行实验,观察到锥形瓶底部有淡黄色浑浊。
(3)请用化学方程式表示出实验原理_________________________________,乙同学在实验过程中对产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据并绘制出图像(如图2)。
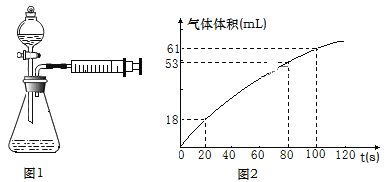
0~20s内反应速率υ1=__________mL·s-1,80~100s内反应速率υ2=__________mL·s-1。不考虑实验测量误差,分析速率差异的主要原因是_____________。