题目内容
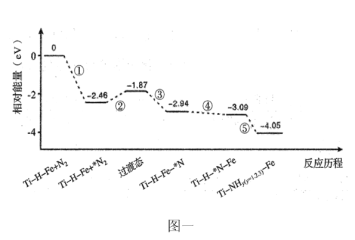
【题目】25℃,用0.1000mol/L的NaOH溶液滴定40.00mL0.1mol/L的某二元弱酸H2R溶液,所得滴定曲线如图所示(设所得溶液体积等于两种溶液体积之和)。下列说法正确的是
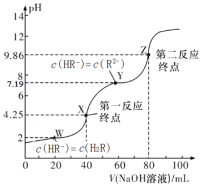
A.若只滴定到第一反应终点,可用酚酞做指示剂
B.图中Y点对应的溶液中:c(Na+)+c(H+)=2c(HR-)+c(OH-)
C.图中Z点对应的溶液中c(Na+)约为0.067mol/L,R2-的水解率大于1%
D.若pK=-lgK,2HR-![]() R2-+H2R达平衡时pK=5.19
R2-+H2R达平衡时pK=5.19
【答案】D
【解析】
NaOH与H2R以物质的量为1:1反应时,即40.00mLNaOH溶液,生成NaHR和H2O,此时溶质为NaHR;
NaOH与H2R以物质的量为2:1反应时,即80.00mLNaOH溶液,生成Na2R和H2O,此时溶质为Na2R。
A.结合图像可知,第一终点时,溶液呈酸性,应用甲基橙作指示剂,不可用酚酞做指示剂,A错误;
B.溶液中存在电荷守恒:c(Na+)+c(H+)=c(HR-)+2c(R2-)+c(OH-),Y点,c(HR-) =c(R2-),则c(Na+)+c(H+)=3c(HR-)+c(OH-),B错误;
C.Z点,溶质为Na2R,溶液体积大约变为H2R溶液体积的3倍,则Na2R的浓度约为起始浓度的三分之一,即0.1000mol/L×![]() ≈0.033mol/L,Na+浓度为Na2R浓度的两倍,即0.067mol/L,R2-+H2O
≈0.033mol/L,Na+浓度为Na2R浓度的两倍,即0.067mol/L,R2-+H2O![]() HR-+OH-,pH=9.86,则c(H+)=10-9.86,c(OH-)=
HR-+OH-,pH=9.86,则c(H+)=10-9.86,c(OH-)=![]() ,R2-的浓度约等于Na2R的浓度,故水解率≈
,R2-的浓度约等于Na2R的浓度,故水解率≈![]() =(3.30×10-1.14)%<1%,C错误;
=(3.30×10-1.14)%<1%,C错误;
D.H2R![]() H++HR-,Ka1=
H++HR-,Ka1=![]() ,由图可知,c(HR-)=c(H2R)时,pH=2,即c(H+)=10-2,则Ka1=10-2,HR-
,由图可知,c(HR-)=c(H2R)时,pH=2,即c(H+)=10-2,则Ka1=10-2,HR-![]() H++R2-,Ka2=
H++R2-,Ka2=![]() ,由图可知,c(HR-)=c(R2-)时,pH=7.19,即c(H+)=10-7.19,则Ka2=10-7.19,2HR-
,由图可知,c(HR-)=c(R2-)时,pH=7.19,即c(H+)=10-7.19,则Ka2=10-7.19,2HR-![]() R2-+H2R的K=
R2-+H2R的K=![]() =
=![]() ×
×![]() =
=![]() =
=![]() =
=![]() ,故pK=-lg(10-5.19)=5.19,D正确。
,故pK=-lg(10-5.19)=5.19,D正确。
答案选D。

【题目】利用含铬废料(主要含 Cr2O3,还含有 FeO、SiO2、Al2O3 等杂质)制备重铬酸钠,实现清洁化工生产,工艺流程如图:
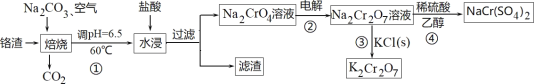
回答下列问题:
(1)焙烧 Cr2O3 转化为Na2CrO4 的化学反应方程式是_____;
(2)实验室模拟此工业流程①,控制反应温度 60℃的方法是_____;
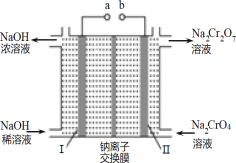
(3)流程②用石墨做电极电解 Na2CrO4 溶液,制备Na2Cr2O7,其原理如图所示,a 是_____极;电极Ⅱ的电极反应式是_____;当生成 2mol Na2Cr2O7时,电路中转移的电子_____mol;
(4)由下图和下表中的溶解度变化,流程③制备 K2Cr2O7,应先充分加热,然后_____反应才能顺利进行;

重铬酸钠的溶解度表:
温度℃ | 10 | 20 | 40 | 60 | 80 | 100 |
溶解度% | 61.6 | 62.8 | 65.1 | 71.8 | 78.7 | 81.1 |
(5)为进一步减少制得的 K2Cr2O7 晶体中 NaCl 等杂质,应再进行_____操作;
(6)流程④Na2Cr2O7 溶液与乙醇反应,乙醇可能被氧化为_____(写一种即可)。