题目内容
5.(1)含0.4mol Al2(SO4)3的溶液中,含1.2mol SO42-,Al3+物质的量<0.8mol(填“>”“<”或“=”)(2)1L 0.1mol•L-1的HClO溶液中,n(HClO)<0.1mol,n(ClO-)<0.1mol,n(H2O)>0.1mol(填“>”“<”或“=”)
分析 (1)硫酸根物质的量为硫酸铝的3倍,溶液中铝离子发生水解;
(2)HClO是弱电解质,存在平衡HClO?H++ClO-,由物料守恒可知,溶液中n(HClO)+n(ClO-)=1L×0.1mol•L-1,稀溶液中水的物质的量远远大于n(HClO)+n(ClO-);
解答 解:(1)n( SO42-)=3n[Al2(SO4)3]=0.4mol×3=1.2mol,溶液中铝离子发生水解,故Al3+物质的量<0.4mol×2=0.8mol,故答案为:1.2;<;
(2)HClO是弱电解质,存在平衡HClO?H++ClO-,由物料守恒可知,溶液中n(HClO)+n(ClO-)=1L×0.1mol•L-1=0.1mol,则n(HClO)<0.1mol,n(ClO-)<0.1mol,稀溶液中水的物质的量远远大于n(HClO)+n(ClO-),即n(H2O)>0.1mol,故答案为:<;<;>.
点评 本题考查盐类水解、弱电解质的电离等,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
15.下列有关SO2说法中不正确的是( )
| A. | 被酸雨污染的农田及湖泊可洒石灰石粉末,减轻其危害 | |
| B. | 在BaC12溶液中通入SO2气体,溶液仍澄清,滴入8%过氧化氢溶液有白色沉淀 | |
| C. | 二氧化硫气体能用浓硫酸干燥,说明二氧化硫无还原性 | |
| D. | 二氧化硫能漂白某些物质,加热后可恢复原色 |
13.进行过滤操作应选用的一组仪器是( )
| A. | 烧杯、试管夹、漏斗、玻璃棒 | B. | 烧杯、酒精灯、试管、漏斗 | ||
| C. | 漏斗、玻璃棒、烧杯、铁架台 | D. | 玻璃棒、烧杯、漏斗、蒸发皿 |
20.取ag某物质放在盛有足量过氧化钠固体的容器中,然后通入足量02,用电火花不断引燃使其充分反应,最后称得固体的质量增加小于ag,则该物质是( )
| A. | 甘油[HOCH2-CH(OH)-CH2OH] | B. | 烃基乙酸[OHCH2COOH] | ||
| C. | 葡萄糖(C6H12O6) | D. | 蔗糖(C12H22O11) |
3.现有部分短周期元素的性质与原子(或分子)结构如下表:
(1)W在周期表中位于第二周期第VIA主族;元素Y与元素Z相比,金属性较强的是Na(用元素符号表示).下列表述中能证明这一事实的是cd(填序号).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.单质Y能与冷水剧烈反应而Z不能
d.最高价氧化物对应的水化物碱性YOH强于Z(OH)2
(2)上述元素可形成含有共价键的二元离子化合物(包含两种不同元素的离子化合物),该化合物的化学式为Na2O2,该物质中阴阳离子个数比为1:2.
(3)W、X的氢化物H2W2、X2H4在一定条件下反应可得到一种在空气中体积分数最大的单质与常温下为液体的物质,写出该反应的化学方程式:2H2O2+N2H4=N2+4H2O.
| 元素符号 | W | X | Y | Z |
| 原子消息 | 海水中质量分数最高的元素 | 非金属性强而单质(X2)很稳定 | M层比K层少1个电子 | 第三周期元素的简单离子中半径最小 |
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.单质Y能与冷水剧烈反应而Z不能
d.最高价氧化物对应的水化物碱性YOH强于Z(OH)2
(2)上述元素可形成含有共价键的二元离子化合物(包含两种不同元素的离子化合物),该化合物的化学式为Na2O2,该物质中阴阳离子个数比为1:2.
(3)W、X的氢化物H2W2、X2H4在一定条件下反应可得到一种在空气中体积分数最大的单质与常温下为液体的物质,写出该反应的化学方程式:2H2O2+N2H4=N2+4H2O.
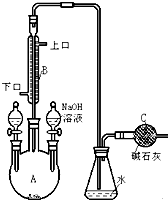 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题: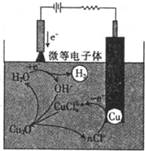 氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:
氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题: