题目内容
能源短缺是人类社会面临的重大问题,世界各国都在努力寻找新能源,探求绿色能源的开发。甲醇是一种可再生能源,是一种污染性较小,热值较大的能源,因而具有广泛的开发价值和良好的应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:
反应Ⅱ:
①上述反应符合“原子经济”原则的是_________(填“I’’或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)

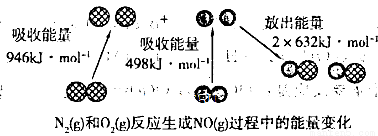
由表中数据判断△H1_________0(填“>”、“=”或“<”),说明生成物的总能量一定_______(填“>”、“=”或“<”)反应物的总能量。
③反应Ⅱ反应历程如下图,回答下列问题;在反应体系中加入催化剂,反应速率增大,E1、E2和△H2的变化是:E1_________、E2_________、△H2_________(填“增大”“减小”“不变”)。

(2)最新研制的一种新型甲醇电池示意图如图,电池的两极分别充人甲醇和氧气(池内为酸性介质)。则电池工作时____________(填a或b)为正极,a极的电极反应式为______________。
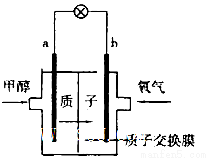
(1)①Ⅰ ②< < ③减小 减小 不变(2)b CH3OH+H2O—6e—=CO2+6H+。
【解析】
试题分析:(1)①原子经济性原则是指原子利用率高,Ⅰ是化合反应,原子利用率高达100%,答案为:Ⅰ;②根据表中数据可以看出,温度越高平衡常数越小,可以确定该反应是放热反应,△H1<0,说明生成物的总能量一定小于反应物的总能量;③使用催化剂能降低反应的活化能,但不能改变反应的始终态,不能改变反应的焓变,答案为:减小、减小、不变;(2)在燃料电池中,正极是通入氧气的电极,发生得电子的还原反应,即O2+2H2O+4e-=4OH-,答案为:b;a极为通入甲醇的电极,电极反应式为CH3OH+H2O—6e—=CO2+6H+。
考点:考查绿色化学原子经济性、化学平衡、催化剂对化学反应的影响、燃料电池。