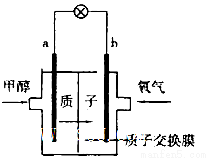
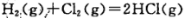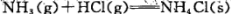题目内容
根据下列热化学方程式
(1)C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
(2)H2(g)+ O2(g)=H2O(1) △H2=-285.8 kJ/mol
O2(g)=H2O(1) △H2=-285.8 kJ/mol
(3)CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(1)的△H为
A.△H=+244.1kJ/mol B.△H=-488.3 kJ/mol
C.△H=-996.6 kJ/mol D.△H=+996.6 kJ/mol
B
【解析】
试题分析:(1)C(s)+O2(g)═CO2 (g)△H1=-393.5kJ/mol
(2)H2(g)+1/2O2(g)═H2O(l)△H2=-285.8kJ/mol
(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
依据盖斯定律(1)×2-(3)+(2)×2得到
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3 kJ/mol故选B.
考点:本题考查热化学方程式的书写和盖斯定律的计算应用,

练习册系列答案
相关题目