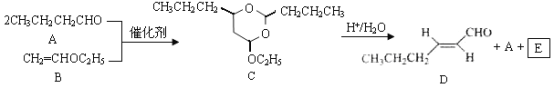
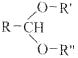
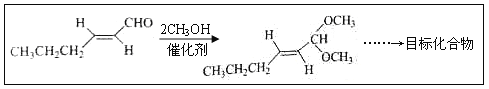
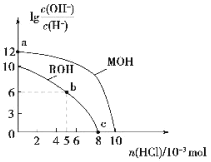
题目内容
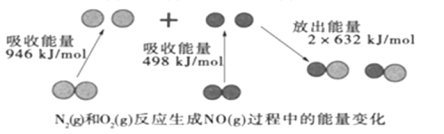
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
下列说法中正确的是( )
A.1molN2(g)和1molO2(g)完全反应放出的能量为180kJ
B.通常情况下,N2(g)和O2(g)混合能直接生成NO
C.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
【答案】C
【解析】
A.焓变=反应物断裂化学键吸收的能量生成物形成化学键放出的能量,N2+O2═2NO,△H=946kJ/mol+498kJ/mol2×632kJ/mol=+180kJ/mol,反应是吸热反应,故A错误;
B. 通常情况下,N2(g)和O2(g)混合不能直接生成NO,需要放电条件,故B错误;
C. 由图中数据可得反应物键的断裂吸收(946+498)=1444kJ/mol的能量,生成物键的形成放出2×632=1264kJ/mol的能量,故该反应是吸热反应,依据能量守恒,1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量,故C正确;
D. 一氧化氮不是酸性氧化物,物质分类中属于不成盐氧化物,不能和氢氧化钠反应,故D错误;
答案选C。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目