题目内容
2.人类生活和工业生产都离不开金属.请根据相关信息回答:(1)235U可用于核能发电.科学家们采用“气体扩散法”从UF6获得高浓度的235U.已知UF6在常温常压下是固体,在56.4℃升华成气体,说明UF6 属于分子晶体.
(2)某丁香酸金属铜配合物的结构简式如图所示,请回答.

该化合物中碳原子的杂化方式有sp3、sp2,Cu原子的外围电子排布式3d104s1.
(3)某铜的配合物在煤的液化中起催化作用,其阳离子结构如下图.

①在该离子内部含有的化学键类型有bcd(填字母).
a.离子键 b.极性键 c.非极性键 d.配位键 e.范德华力 f.氢键
②煤液化获得的甲醇经催化氧化可得到重要工业原料甲醛(HCHO).甲醇的沸点 64.96℃,甲醛的沸点-21℃,
甲醛的沸点更低的原因是分子间没有氢键.你认为甲醛分子间没有氢键的原因是甲醛分子中氢原子与碳原子形成共价键,碳的电负性较小,不构成形成氢键的条件.
③甲醛分子σ键和π键的个数比为3:1.
(4)具有6 配位的Co3+的配合物[Co(NH3)mCln]Cl(3-n)具有一定的抗肿瘤活性.1mol该配合物与足量AgNO3溶液反应生成2mol AgCl沉淀,则 m=5、n1.
分析 (1)已知UF6在常温常压下是固体,在56.4℃升华成气体,其沸点低,所以UF6是分子晶体;
(2)甲基上的碳是sp3杂化,其它碳是sp2杂化;Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1;
(3)①在该离子内部含有的化学键类型有碳氢和碳氮极性共价键,碳碳非极性共价键,以及铜与氮之间形成的配位键;
②根据形成氢键的条件分析;
③利用判断σ键的规律来分析σ键数目和π键的数目;
(4)外界电离,内界不电离,以及Ag++Cl-=AgCl↓,来分析求解.
解答 解:(1)已知UF6在常温常压下是固体,在56.4℃升华成气体,其沸点低,所以UF6是分子晶体,故答案为:分子;
(2)甲基上的碳是sp3杂化,其它碳是sp2杂化,Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,所以外围电子排布式为:3d104s1,故答案为:sp3、sp2;3d104s1;
(3)某铜的配合物在煤的液化中起催化作用,其阳离子结构如下图.
①在该离子内部含有的化学键类型有碳氢和碳氮极性共价键,碳碳非极性共价键,以及铜与氮之间形成的配位键,故选:bcd;
②电负性较强的元素如N、O、F与H形成共价键时,能形成氢键,而C的电负性较弱,与H形成共价键后,不能形成氢键,
故答案为:甲醛分子中氢原子与碳原子形成共价键,碳的电负性较小,不构成形成氢键的条件;
③甲醛中含有一个C=O,C=O由1个π键和1个σ键构成和2个碳氢σ键构成,所以σ键和π键的个数比为3:1,故答案为:3:1;
(4)1mol该配合物与足量AgNO3溶液反应生成2mol AgCl沉淀,说明3-n=2,所以n=1,又因为具有6 配位所以m=5,故答案为:5;1.
点评 本题考查了分子的类型的判断和原子的杂化方式,涉及电子排布式、晶体的判断、氢键、化学键的判断等,考查的知识点较多,综合性较强.

| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度为700℃.
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.试用平衡常数判断平衡不发生移动(填“发生”或“不发生”).
| A. | 吸热反应中,反应物的总能量大于生成物的总能量 | |
| B. | 形成化学键的过程会释放能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 氧化反应均为吸热反应 |

下列关于橙花醇的叙述,错误的是( )
| A. | 既能发生取代反应,也能发生加成反应 | |
| B. | 在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 1mol橙花醇与浓氢溴酸反应,最多消耗3mol HBr | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗 480g Br2 |
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:生成的Mn2+在反应中起到催化剂的作用,加快了反应速率
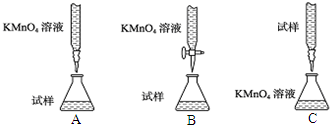
【实验目的】探究草酸与高锰酸钾反应的速率变化“异常”原因;
【实验用品】仪器:试管、胶头滴管、量筒、药匙、玻璃棒等;
试剂:0.1mol/LH2C2O4溶液、0.05mol/LKMnO4(硫酸酸化)溶液等.
请你根据该兴趣小组的实验探究设计思路,补充完整所缺内容.
(1)KMnO4溶液可用硫酸酸化,而为什么不能用盐酸酸化,请用离子方程式进行说明:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
(2)草酸溶液与酸性KMnO4溶液反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
(3)要完成对猜想Ⅰ的实验验证,至少还需要一种实验仪器是温度计.
(4)要设计实验验证猜想Ⅱ,进行该实验还要补充的一种试剂是MnSO4(s),一种仪器是秒表.
(5)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
| 对比实验 | 试管A | 试管B |
| 加入试剂 | 1ml0.05mol/l KMnO4 2ml0.1mol/l H2C2O4 | 1ml0.05mol/lKMnO4 2ml0.1mol/lH2C2O4 少量MnSO4 |
| (预期)实验现象 (褪色时间) | 褪色较慢 | 褪色很快 |
| 结论 | 猜想Ⅱ正确 | |
| A. | 冰熔化时,分子中H-O键发生断裂 | |
| B. | HI比HF易分解,是因为HI分子间不存在氢键 | |
| C. | 非极性键不可能存在于离子化合物中,由非金属元素组成的化合物中一定不存在离子键 | |
| D. | 含有阴离子的物质一定含有阳离子 |
| A. | 在Na2CO3的水溶液中存在:2c(Na+)=c(CO32-)+c(HCO3-)+2c(H2CO3) | |
| B. | pH=3盐酸与pH=11氨水等体积混合时有:c(NH4+)=c(Cl-)>>c(H+)=c(OH-) | |
| C. | pH均为9的Na2CO3和CH3COONa溶液,二者的水解程度相同 | |
| D. | 在氨水中加水稀释,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ 增大 |