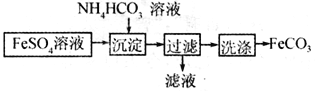
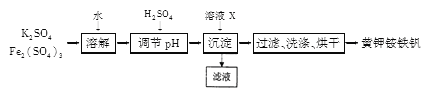
题目内容
【题目】化学反应原理对化学反应的研究具有指导意义.
(1)298K,101KPa时,在1L水中可溶解0.09mol氯气,实验测得溶于说的氯气约有 ![]() 与水反应,该反应的离子方程式为,在上述平衡体系中加入少量NaHCO3固体,溶液中c(H+),c(Cl﹣)(填“增大”、“减小”、“不变”)
与水反应,该反应的离子方程式为,在上述平衡体系中加入少量NaHCO3固体,溶液中c(H+),c(Cl﹣)(填“增大”、“减小”、“不变”)
(2)用水稀释0.1mol/L氨水,溶液中随着水量的增加而增大的是(填字母)
a.c(OH﹣) b.c(NH3H2O) c.c(NH4+)c(OH﹣)
d.NH3H2O的电离程度 e.溶液的导电性
当溶液适当升高温度(不考虑NH3H2O分解和NH3逸出),上述数据增大的是;在溶液中加入少量NH4Cl固体(不考虑溶液温度变化),上述数据增大的是;当加入少量NaOH固体(不考虑溶液温度变化),上述数据增大的是 .
【答案】
(1)增大
(2)d;a、c、d、e;b、e;a、b、e
【解析】解:(1)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2OH++Cl﹣+HClO;在上述平衡体系中加入NaHCO3 , 溶液中的碳酸氢根离子,和氢离子反应,氢离子的浓度减小,平衡正向进行,溶液中Cl﹣浓度增大;所以答案是:Cl2+H2OH++Cl﹣+HClO;减小;增大;(2)随水的加入a.c(OH﹣)减小; b.c(NH3H2O)减小; c.c(NH4+)c(OH﹣)不变; d.NH3H2O的电离程度增大; e.溶液的导电性减弱;所以溶液中随着水量的增加而增大的是NH3H2O的电离程度,当溶液适当升高温度促进电离,上述数据增大的是c(OH﹣)、c(NH4+)c(OH﹣)、NH3H2O的电离程度、溶液的导电性都增强;在溶液中加入少量NH4Cl固体(不考虑溶液温度变化),电离平衡逆向移动,所以c(NH3H2O)、溶液的导电性都增强;当加入少量NaOH固体(不考虑溶液温度变化),氨水的电离平衡逆向移动,导致c(OH﹣)、c(NH3H2O)、溶液的导电性都增强,故选:d;a、c、d、e;b、e;a、b、e.
【考点精析】关于本题考查的化学平衡状态本质及特征,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能得出正确答案.

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案【题目】下列四个试管中,发生如下反应:Zn+2HCl=ZnCl2+H2↑,产生H2的反应速率最小的是( )
试管 | 盐酸浓度 | 温度 | 锌的状态 |
A | 0.5molL﹣1 | 20℃ | 块 状 |
B | 0.5molL﹣1 | 20℃ | 粉末状 |
C | 2molL﹣1 | 35℃ | 块 状 |
D | 2molL﹣1 | 35℃ | 粉末状 |
A.A
B.B
C.C
D.D