题目内容
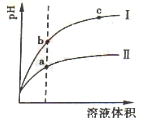
【题目】常温下,向20mL浓度为0.1000mol/L的盐酸中逐滴加入0.1000mol/L的氨水,PH随氨水体积的变化如图。下列说法不正确的是

A. 在B点时:c(H+)=c(OH-)+c(NH3·H2O)
B. 在C点时:c(Cl-)<c(NH4+)+c(NH3·H2O)
C. A点与B点相比:2n(NH4+)A>n(NH4+)B
D. 从C到D的过程中,可能出现:c(Cl-)>c(NH4+)
【答案】D
【解析】A.B点是等浓度、等体积的盐酸和氨水恰好反应生成氯化铵,根据质子守恒,c(H+)=c(OH-)+c(NH3·H2O),A项正确;B.B点是氯化铵溶液,溶液呈酸性,需要加入少量氨水使溶液呈中性,则c(Cl-)<c(NH4+)+c(NH3·H2O),B项正确;C.A点,盐酸反应掉一半,n(NH4+ )=0.01L×0.1000mol/L=0.001mol,B点,盐酸完全反应,n(NH4+ )=0.002mol,A点还存在NH3·H2ONH4+ +OH-,所以2n(NH4+)A>n(NH4+)B,C项正确;D.从C点到D点,溶液呈碱性,c(H+)<c(OH-),根据电荷守恒,c(H+)+c(NH4+ )=c(OH-)+c(Cl-),则c(Cl-)>c(NH4+),D项错误。答案选D。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案【题目】共价键都有键能之说,键能是指拆开1 mol共价键所需要吸收的能量或形成1mol共价键所放出的能量。
(1)已知H—Cl键的键能为431.4 kJ/mol,下列关于键能的叙述正确的是______________。
A.每生成1 mol H—Cl键吸收431.4 kJ能量
B. 每生成1 mol H—Cl键放出431.4 kJ能量
C.每拆开1 mol H—Cl键放出431.4 kJ能量
D. 每拆开1 mol H—Cl键吸收431.4 kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是___________。
化学键 | H—H | H—F | H—Cl | H—Br |
键能/kJ/mol | 436 | 565 | 431 | 368 |
A. H2 B. HF C. HCl D. HBr
(3)能用键能大小解释的是____________。
A 常温常压下,溴呈液态,碘呈固态 B.氮气的化学性质比氧气稳定
C.稀有气体一般很难发生化学反应 D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,常温下,4mol HCl被氧化,放出115.6kJ的热量.
写出该反应的热化学方程式_____________________.
(5)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用如图简单表示(图中的△H表示生成1mol产物的数据)
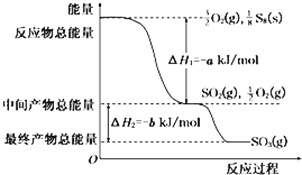
①写出表示S8燃烧热的热化学方程式:______________.
②写出SO3分解生成SO2和O2的热化学方程式:______________.