题目内容
【题目】共价键都有键能之说,键能是指拆开1 mol共价键所需要吸收的能量或形成1mol共价键所放出的能量。
(1)已知H—Cl键的键能为431.4 kJ/mol,下列关于键能的叙述正确的是______________。
A.每生成1 mol H—Cl键吸收431.4 kJ能量
B. 每生成1 mol H—Cl键放出431.4 kJ能量
C.每拆开1 mol H—Cl键放出431.4 kJ能量
D. 每拆开1 mol H—Cl键吸收431.4 kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是___________。
化学键 | H—H | H—F | H—Cl | H—Br |
键能/kJ/mol | 436 | 565 | 431 | 368 |
A. H2 B. HF C. HCl D. HBr
(3)能用键能大小解释的是____________。
A 常温常压下,溴呈液态,碘呈固态 B.氮气的化学性质比氧气稳定
C.稀有气体一般很难发生化学反应 D.硝酸易挥发而硫酸难挥发
(4)已知:4HCl+O2═2Cl2+2H2O,常温下,4mol HCl被氧化,放出115.6kJ的热量.
写出该反应的热化学方程式_____________________.
(5)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用如图简单表示(图中的△H表示生成1mol产物的数据)
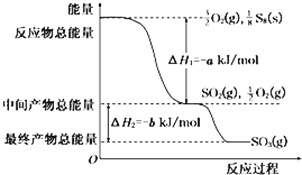
①写出表示S8燃烧热的热化学方程式:______________.
②写出SO3分解生成SO2和O2的热化学方程式:______________.
【答案】 B D B B 4HCl(g)+O2(g)═2Cl2(g)+2H2O ΔH=—115.6kJ·mol-1 S8(s)+8O2=S8(s)+8O2(g)=8SO2(g) △H=-8aKJ/mol SO3(g)=SO2(g)+1/2O2(g) △H=+bKJ/mol
【解析】(1)已知H-Cl键的键能为431.4kJ/mol,所以要拆开1 molH-Cl键需要吸收431.4kJ能量,要形成1 molH-Cl键需要放出431.4kJ能量;故答案为:BD;
(2)键能越大,键越稳定,由表格数据可知,HF的键能最大,则HF最稳定;
故答案为:B;
(3)A.分子间作用力越大,分子晶体的熔点越高,常温常压下,溴呈液态,碘呈固态,是因为单质碘的分子间作用力大,与键能无关,故A错误;B.键能越大,分子越稳定,氮气中的共价键的键能比氧气的大,所以氮气的化学性质比氧气稳定,能用键能解释,故B正确; C.稀有气体为单原子分子,没有化学键,很难发生化学反应,是因为原子达到8电子稳定结构,不易形成化学键,故C错误;D.物质想挥发性与其沸点有关,分子晶体的沸点与分子间作用力有关,与键能无关,故D错误;故答案为:B;
(4)在反应中4HCl+O2═2Cl2+2H2O,4mol HCl被氧化,放出115.6kJ的热量,反应的热化学方程式为4HCl(g)+O2(g)═2Cl2(g)+2H2O ΔH=—115.6kJ·mol-1,故答案为:4HCl(g)+O2(g)═2Cl2(g)+2H2O ΔH=—115.6kJ·mol-1;
(5)①依据图象分析1molO2和![]() molS8反应生成二氧化硫放热aKJ/mol,依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,根据概念先写出化学方程式,标注物质聚集状态,反应反应热,热化学方程式为:S8(s)+8O2(g)=8SO2(g)△H=-8aKJ/mol,故答案为:S8(s)+8O2(g)=8SO2(g)△H=-8aKJ/mol;
molS8反应生成二氧化硫放热aKJ/mol,依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,根据概念先写出化学方程式,标注物质聚集状态,反应反应热,热化学方程式为:S8(s)+8O2(g)=8SO2(g)△H=-8aKJ/mol,故答案为:S8(s)+8O2(g)=8SO2(g)△H=-8aKJ/mol;
②依据图象分析结合反应能量变化,写出化学方程式,标注物质聚集状态和反应热,SO3分解生成SO2和O2的热化学方程式为:SO3(g)=SO2(g)+ ![]() O2(g)△H=bKJ/mol,故答案为:SO3(g)=SO2(g)+
O2(g)△H=bKJ/mol,故答案为:SO3(g)=SO2(g)+ ![]() O2(g)△H=+bKJ/mol。
O2(g)△H=+bKJ/mol。

 名校课堂系列答案
名校课堂系列答案【题目】短周期中三元素a,b,c在周期表中的位置如图,下列有关这三种元素的叙述正确的是( )
a | ||
b | ||
c |
A.a是一种活泼的非金属元素
B.c的最高价氧化物的水化物是一种弱酸
C.b的氢化物很稳定
D.b元素的最高化合物为+7价
【题目】如表是元素周期表的前四周期:
I A | II A | III A | IV A | V A | VI A | VII A | 0 | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三 | G | H | I | |||||
四 | J |
回答下列问题:
(1)G元素与E元素形成含有非极性键的化合物的化学式是____,I与J的原子序数相差为_____.
(2)上述10种元素的最高价氧化物对应的水化物中,碱性最强的是__(用化合物的化学式表示,下同),酸性最强的是_____,E、F、G三种元素形成的简单离子半径由大到小的顺序是_______(用离子符号回答).

