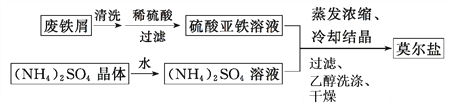
题目内容
【题目】【2016课标Ⅲ】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
【答案】(3)酸;除去溶液中溶解的CO2;
(4)CaCl2+2NH3·H2O+H2O2=CaO2↓+2NH4Cl+2H2O或CaCl2+2NH3·H2O+H2O2+6H2O=CaO2·8H2O↓+2NH4Cl;温度过高时过氧化氢分解;(5)去除结晶表面水分;(6)工艺简单、操作方便;纯度较低。
【解析】(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,溶液中有二氧化碳生成,因此溶液呈酸性。溶液中含有二氧化碳,而过氧化钙能与酸反应,因此将溶液煮沸的作用是除去溶液中溶解的CO2。
(4)根据原子守恒可知反应中还有氯化铵和水生成,则步骤③中反应的化学方程式为CaCl2+2NH3·H2O+H2O2=CaO2↓+2NH4Cl+2H2O;双氧水不稳定,受热易分解,因此该反应需要在冰浴下进行的原因是防止过氧化氢分解。
(5)过氧化钙不溶于乙醇,使用乙醇洗涤的目的是去除结晶表面的水分。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是原料来源丰富、操作方便,产品的缺点是得到产品的纯度较低。

【题目】短周期中三元素a,b,c在周期表中的位置如图,下列有关这三种元素的叙述正确的是( )
a | ||
b | ||
c |
A.a是一种活泼的非金属元素
B.c的最高价氧化物的水化物是一种弱酸
C.b的氢化物很稳定
D.b元素的最高化合物为+7价
【题目】如表是元素周期表的前四周期:
I A | II A | III A | IV A | V A | VI A | VII A | 0 | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三 | G | H | I | |||||
四 | J |
回答下列问题:
(1)G元素与E元素形成含有非极性键的化合物的化学式是____,I与J的原子序数相差为_____.
(2)上述10种元素的最高价氧化物对应的水化物中,碱性最强的是__(用化合物的化学式表示,下同),酸性最强的是_____,E、F、G三种元素形成的简单离子半径由大到小的顺序是_______(用离子符号回答).