题目内容
14.已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)═CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成.则A应该属于d(用字母代号填写)
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,已知MnO4-→Mn2+请写出此反应的离子方程式MnO4-+5SO2+2H2O═5SO42-+2Mn2++4H+,并计算吸收标准状况下4.48L的A物质需2mol/L的KMnO4溶液40 mL
(2)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了 0.2mol电子,生成的CuSO4的质量为16g,生成的A气体在标准状况下体积为2.24L (假设气体全部逸出).
(3)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应.请写出此过程发生的反应的离子方程式:Ba2++SO42-+2OH-+2H+=2H2O+BaSO4↓、Ba2++SO42-+2OH-+Cu2+=Cu(OH)2↓+BaSO4↓.
分析 (1)由原子个数守恒定律可知反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+A↑+2H2O中,A为SO2;
二氧化硫具有还原性,能够被酸性的高锰酸钾氧化生成硫酸根离子,据此写出方程式,依据方程式计算消耗高锰酸钾体积;
(2)依据Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知转移2mol电子生成1mol硫酸铜,1mol二氧化硫气体;
(3)反应后剩余溶液为硫酸和硫酸铜溶液,加入氢氧化钡,硫酸与氢氧化钡反应生成硫酸钡和水,硫酸铜与氢氧化钡反应生成硫酸钡和氢氧化铜沉淀.
解答 解:(1)铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)═CuSO4+A↑+2H2O,依据原子个数守恒可知A为二氧化硫,故选d;
二氧化硫具有还原性,能够被酸性的高锰酸钾氧化生成硫酸根离子,离子方程式:MnO4-+5SO2+2H2O═5SO42-+2Mn2++4H+,
4.48L标况下二氧化硫的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,依据方程式得:
MnO4-+5SO2+2H2O═5SO42-+2Mn2++4H+,
1 5
n 0.2mol
解得n=0.04mol,需要高锰酸钾体积V=$\frac{0.04mol}{2mol/L}$=0.02L,即20mL;
故答案为:d;MnO4-+5SO2+2H2O═5SO42-+2Mn2++4H+;20;
(2)依据Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知转移2mol电子生成1mol硫酸铜,1mol二氧化硫气体,所以如果该反应过程中转移了 0.2mol电子,生成的CuSO4的物质的量为0.1mol,质量为0.1mol×160g/mol=16g;生成二氧化硫物质的量为0.1mol,标况下体积为0.1mol×22.4L/mol=2.24L;
故答案为:16;2.24;
(3)反应后剩余溶液为硫酸和硫酸铜溶液,加入氢氧化钡,硫酸与氢氧化钡反应生成硫酸钡和水,离子方程式:Ba2++SO42-+2OH-+2H+=2H2O+BaSO4↓,硫酸铜与氢氧化钡反应生成硫酸钡和氢氧化铜沉淀,离子方程式:Ba2++SO42-+2OH-+Cu2+=Cu(OH)2↓+BaSO4↓,
故答案为:Ba2++SO42-+2OH-+2H+=2H2O+BaSO4↓、Ba2++SO42-+2OH-+Cu2+=Cu(OH)2↓+BaSO4↓.
点评 本题考查了离子方程式的书写、有关方程式的计算,明确反应实质及浓硫酸、二氧化硫的性质是解题关键,题目难度中等.

| A. | 纳米铜是一种新型化合物 | |
| B. | 纳米铜颗粒比普通铜具有更强的化学活性 | |
| C. | 纳米铜粒子大小介于1~100 nm | |
| D. | 利用丁达尔现象可区别纳米铜和普通铜 |
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子所以能导电 | |
| B. | 二氧化硫的水溶液能导电,所以二氧化硫是电解质 | |
| C. | 硫酸钡难溶于水,但硫酸钡属于电解质 | |
| D. | 液态氯化氢不导电,所以氯化氢是非电解质 |
 有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”.例如,如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列应,生成的有机物分子中仍含有手性碳原子的是( )
有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”.例如,如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列应,生成的有机物分子中仍含有手性碳原子的是( )| A. | 催化剂作用下与H2反应 | B. | 与NaOH水溶液反应 | ||
| C. | 发生银镜反应 | D. | 与乙酸发生酯化反应 |
| A. | CH3Cl | B. | CCl3C Cl3 | C. | 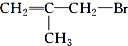 | D. | 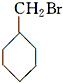 |
此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.
在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应).
| 实验 序号 | 温度℃ | 初始CCl4浓度 (mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的平衡转化率 |
| 1 | 110 | 1 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
(2)实验l中,CCl4的转化率A大于50%(填“大于”、“小于”或“等于”).
(3)实验3中,B的值D(选填序号).
A.等于50% B.大于50% C.小于50%D.从本题资料,无法判断
(4)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2mol•L-1和4mol•L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线).在图中的四条线中,表示H2起始浓度为2mol•L-1实验的消耗CCl4的百分率变化曲线是c(选填序号).

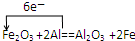 .
.