题目内容
15.为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4+H2?CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.
在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应).
| 实验 序号 | 温度℃ | 初始CCl4浓度 (mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的平衡转化率 |
| 1 | 110 | 1 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
(2)实验l中,CCl4的转化率A大于50%(填“大于”、“小于”或“等于”).
(3)实验3中,B的值D(选填序号).
A.等于50% B.大于50% C.小于50%D.从本题资料,无法判断
(4)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2mol•L-1和4mol•L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线).在图中的四条线中,表示H2起始浓度为2mol•L-1实验的消耗CCl4的百分率变化曲线是c(选填序号).

分析 (1)实验2中110℃平衡时CCl4的平衡转化率为50%,则其浓度变化量为0.5mol/L,则:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g)
起始浓度(mol/L):1 1 0 0
变化浓度(mol/L):0.5 0.5 0.5 0.5
平衡浓度(mol/L):0.5 0.5 0.5 0.5
再根据K=$\frac{c(CHC{l}_{3})×c(HCl)}{c(CC{l}_{4})×c({H}_{2})}$计算平衡常数;
(2)实验l中等效为在实验2平衡的基础上再加入0.2mol氢气,平衡正向移动,CCl4的转化率大于实验2中的转化率;
(3)实验3等效为在实验2的基础上降低温度,由于不知道反应是吸热反应,还是放热反应,不能确定降低温度平衡移动方向;
(4)氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢.
解答 解:(1)①因CCl4的沸点为77℃,CHCl3的沸点为61.2℃,所以在110℃或100℃反应时各物质均为气态,110℃时,实验2达到平衡,CCl4的转化率为50%,则其浓度变化量为0.5mol/L,则:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g)
起始浓度(mol/L):1 1 0 0
变化浓度(mol/L):0.5 0.5 0.5 0.5
平衡浓度(mol/L):0.5 0.5 0.5 0.5
平衡常数K=$\frac{c(CHC{l}_{3})×c(HCl)}{c(CC{l}_{4})×c({H}_{2})}$=$\frac{0.5×0.5}{0.5×0.5}$=1,
故答案为:1;
(2)实验l中等效为在实验2平衡的基础上再加入0.2mol氢气,平衡正向移动,CCl4的转化率大于实验2中的转化率,即实验l中,CCl4的转化率>50%,故答案为:大于;
(3)实验3等效为在实验2的基础上降低温度,由于不知道反应是吸热反应,还是放热反应,不能确定降低温度平衡移动方向,所以无法判断转化率的大小,故答案为:D;
(4)由图象可知,氢气浓度越大反应越快,消耗CCl4的百分率变化就越快,相反就比较慢,所以H2起始浓度为2mol/L时,消耗CCl4的百分率变化曲线是c,故答案为:c.
点评 本题考查化学平衡计算与影响因素、化学平衡常数计算等,难度中等,注意掌握三段式计算与平衡常数的应用.

| A. | c1:c2>1:2 | |
| B. | A和B的转化率不相等 | |
| C. | 平衡时,B和C的生成速率之比1:1 | |
| D. | c2的取值范围为0<c2<0.28 mol•L-1 |
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:| 温度/℃ | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号).
a.增大压强 b.使用合适的催化剂 c.升高温度 d.及时分离出产物中的NH3
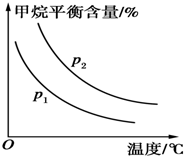
(2)原料气H2可通过反应CH4(g)+H2O(g)?CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是p1<p2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)?CO2(g)+H2 (g)获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容积固定为5L的容器中进行反应,下列描述能够说明体系处于平衡状态的是cd(填字母序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
| A. | 分子式为C5H12的烷烃,含有3个甲基结构的同分异构体有2种 | |
| B. | 丙烯能发生加成反应,还能使酸性KMnO4溶液褪色 | |
| C. | 甲苯中所有原子都处于同一平面 | |
| D. | 相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多 |
 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某《化学教育》杂志报道了如下实验研究: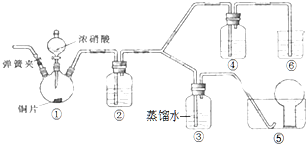 某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.
某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去).实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO.由此得出的结论是浓硝酸的氧化性强于稀硝酸.