题目内容
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应 2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:υ正=υ(NO2)消耗=k正c2(NO2),υ逆=υ(NO)消耗=2υ(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A.反应达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1∶1
B.反应达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.反应达平衡时,容器Ⅲ中NO的体积分数大于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1
【答案】D
【解析】
A.容器I中的反应

化学平衡常数K=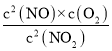 =
=![]() =0.8;
=0.8;
容器II中开始时浓度商Qc=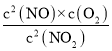 =
=![]() =
=![]() <0.8,则反应正向进行,平衡时混合气体的物质的量浓度之和大于1mol/L,所以达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于0.8mol/L:1mol/L=4:5,故A错误;
<0.8,则反应正向进行,平衡时混合气体的物质的量浓度之和大于1mol/L,所以达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于0.8mol/L:1mol/L=4:5,故A错误;
B.容器I中反应平衡时c(O2)=c(NO2),如果容器II中平衡时 c(NO2)=c(O2),设参加反应的 c(NO2)=xmol/L,则0.3-x=0.2+0.5x,解得x=![]() ,平衡时 c(NO2)=c(O2)=
,平衡时 c(NO2)=c(O2)=![]() mol/L,c(NO)=0.5mol/L+
mol/L,c(NO)=0.5mol/L+![]() mol/L=
mol/L=![]() mol/L,II中Qc=
mol/L,II中Qc=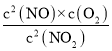 =
= ≈1.4>0.8,说明II中平衡时应该存在 c(NO2)>c(O2),即容器Ⅱ中
≈1.4>0.8,说明II中平衡时应该存在 c(NO2)>c(O2),即容器Ⅱ中 ![]() <1,而容器I中
<1,而容器I中 ![]() =1,所以达平衡时,容器Ⅱ中
=1,所以达平衡时,容器Ⅱ中 ![]() 比容器Ⅰ中的小,故B错误;
比容器Ⅰ中的小,故B错误;
C.若容器Ⅲ在某时刻,NO的体积分数为50%,可得反应的三段式:
2NO2(g)2NO(g)+O2(g)
起始量(mol/L) 0 0.5 0.35
变化量(mol/L) 2y 2y y
平衡量(mol/L) 2y 0.5-2y 0.35-y
若0.5-2y=2y+0.35-y,解得y=0.05,求出此时浓度商Qc=![]() =4.8>K,说明此时反应未达平衡,反应继续向逆反应方向进行,NO进一步减少,平衡时NO的体积分数小于50%,故C错误;
=4.8>K,说明此时反应未达平衡,反应继续向逆反应方向进行,NO进一步减少,平衡时NO的体积分数小于50%,故C错误;
D.υ正=υ(NO2 )消耗=k正c2(NO2 ),υ逆=υ(NO)消耗=2υ(O2 )消耗
故答案为D。

【题目】已知反应![]() ,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
t/min | 2 | 4.5 | 5 | 6 |
X的转化率 | 30% | 40% | 70% | 70% |
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5min时,![]()
C.6min时,容器中剩余1.4molY
D.其他条件不变,将X的物质的量改为10mol,则可得到4molZ
【题目】对下列实验事实的解释正确的是( )
现象 | 解释或结论 | |
A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
C | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
A.AB.BC.CD.D